Катехоламины
Строение
Гормоны надпочечников адреналин и норадреналин под общим названием катехоламины представляют собой производные аминокислоты тирозина.
Роль адреналина является гормональной, норадреналин преимущественно является нейромедиатором.
Синтез
Осуществляется в клетках мозгового слоя надпочечников (80% всего адреналина), синтез норадреналина (80%) происходит также в нервных синапсах.
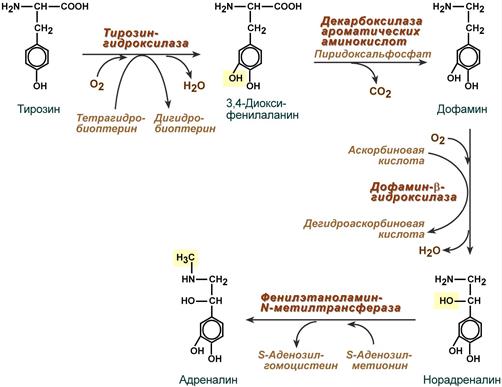
Реакции синтеза катехоламинов
Регуляция синтеза и секреции
Активируют: стимуляция чревного нерва, стресс.
Уменьшают: гормоны щитовидной железы.
Механизм действия
Механизм действия гормонов разный в зависимости от рецептора. Степень активности рецептора может изменяться в зависимости от концентрации соответствующего лиганда.
Например, в жировой ткани при низких концентрациях адреналина более активны α2-адренорецепторы, при повышенных концентрациях (стресс) – стимулируются β1-, β2-, β3-адренорецепторы.
Кальций-фосфолипидный механизм
Аденилатциклазный механизм
- при задействовании α2-адренорецепторов аденилатциклаза ингибируется,
- при задействовании β1— и β2-адренорецепторов аденилатциклаза активируется.
Мишени и эффекты
α1-Адренорецепторы
При возбуждении α1-адренорецепторов происходит:
1. Активация гликогенолиза и глюконеогенеза в печени.
2. Сокращение гладких мышц
- кровеносных сосудов в разных областях тела,
- мочеточников и сфинтера мочевого пузыря,
- предстательной железы и беременной матки,
- радиальной мышцы радужной оболочки,
- поднимающих волос,
- капсулы селезенки.
3. Расслабление гладких мышц ЖКТ и сокращение его сфинктеров,
α2-Адренорецепторы
При возбуждении α2-адренорецепторов происходит:
- снижениелиполиза в результате уменьшения стимуляции ТАГ-липазы,
- подавление секреции инсулина и секреции ренина,
- спазм кровеносных сосудов в разных областях тела,
- расслабление гладких мышц кишечника,
- стимуляция агрегации тромбоцитов.
β1-Адренорецепторы
Возбуждение β1-адренорецепторов (есть во всех тканях) проявляется в основном:
- активациялиполиза,
- расслабление гладких мышц трахеи и бронхов,
- расслабление гладких мышц ЖКТ,
- увеличение силы и частоты сокращений миокарда (ино— и хронотропный эффект).
β2-Адренорецепторы
Возбуждение β2-адренорецепторов (есть во всех тканях) проявляется главным образом:
1. Стимуляция
2. Усиление секреции
3. Расслабление гладких мышц
- трахеи и бронхов,
- желудочно-кишечного тракта,
- беременной и небеременной матки,
- кровеносных сосудов в разных областях тела,
- мочеполовой системы,
- капсулы селезенки,
4. Усиление сократительной активности скелетных мышц (тремор),
5. Подавление выхода гистамина из тучных клеток.
В целом катехоламины отвечают за биохимические реакции адаптации к острому стрессу, эволюционно связанному с мышечной активностью – «борьба или бегство» :
- усиление продукции жирных кислот в жировой ткани для работы мышц,
- мобилизация глюкозы из печени для повышения устойчивости ЦНС,
- поддержание энергетических потребностей работающих мышц за счет поступающей глюкозы и жирных кислот,
- снижение анаболических процессов через уменьшение секреции инсулина.
Адаптация также прослеживается в физиологических реакциях:
Инактивация адреналина
Инактивация адреналина происходит так же, как и обезвреживание других биогенных аминов:
- при участии моноаминоксидазы,
- при действии катехол-О-метил-трансферазы (КОМТ), которая метилирует адреналин по 3-ОН-группе в присутствии S-аденозилметионина,
- конъюгация производных адреналина с глюкуроновой кислотой.
Реакции происходят в печени, основными конечными продуктами являются ванилилминдальная кислота (80% всех метаболитов) и мет-О-адреналин (метанефрин), которые выделяются с мочой. Продолжительность жизни адреналина в кровотоке составляет около 10-30 секунд.
Патология
Гиперфункция
Доброкачественная или злокачественная гормонально-активная опухоль мозгового вещества надпочечников – феохромоцитома . Ее диагностируют только после проявления гипертензии. Гипертонический криз при феохромоцитоме сопровождается сердечно-сосудистыми, желудочно-кишечными, нервно-психическими проявлениями, лейкоцитозом и гипергликемией. Лечение сначала проводят медикаментозно, используя α- и β-адреноблокаторы, для стабилизации состояния. Затем производится удаление опухоли – тотальная адреналэктомия.
Ответы на экзаменационные задачи (из задачника)
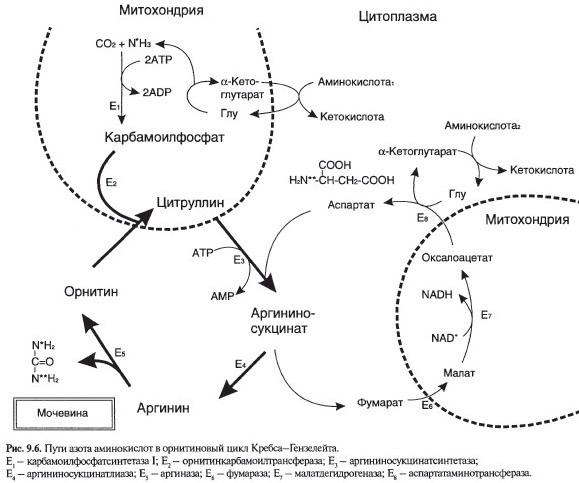
№ 9.2 При наследственном заболевании аргининосукцинутрии суточная экскреция аргининосукцината почками достигает 3 г (в норме отсутствует). Укажите возможную причину и проявления этого заболевания. Для этого:
а) Напишите схему орнитинового цикла
б) На схеме укажите место ферментного блока
в) Перечислите вещества, содержание которых повышено в крови данного больного
Проявления отравления аммиаком: снижается проведение нервного импульса, так ионы NH4 похожи на ионы натри; снижение активности Na/K Атфазы, снижение скорости ЦТК, снижение скорости обмена аминокислот, снижение количества АТФ, и, как следствие, гипоэнергетическое состояние, снижение активности тормозных медиаторов, накопление глутамина в нервных клетках приводит к увеличению осмотического давления, что приводит к задержке воды и следовательно, отёк мозга.
в) Идёт накопление аммиака, карбамоилфосфата, цитрулина, аргининосукцината
№ 9.3 Объясните, каковы причины повторяющейся рвоты, припадков с потерей сознания ребенка в возрасте 4 мес, если в крови обнаружена высокая концентрация цитруллина:
а) Ответ проиллюстрируйте схемой нарушенного процесса, указав место ферментативного блока
б) Объясните механизмы развития перечисленных симптомов
в) Почему состояние больного улучшается при назначении малобелковой диеты
Причина – цитрулинемия, дефект фермента аргининосукцинатсинтетазы.
Место ферментативного блока:
б) Снижении активности фермента аргининосукцинатсинтетазы приводит к накоплению в крови цитрулина и его предшественников. Повышается концентрация аммиака, карбомоилфосфата.
в) При малобелковой диете в организм поступает меньше аминокислот, а следовательно уменьшается количество аммиака.
№ 9.4 Пациенты с наследственными нарушениями орнитинового цикла избегают белковой пищи, у них отмечаются приступы рвоты, сонливость, судорожные припадки и умственная отсталость. Выскажите предположения о причинах наблюдаемых явления. Для этого:
а) Напишите схему орнитинового цикла, укажите ферменты
б) Объясните, в чем заключается биологическая роль орнитинового цикла
в) Перечислите вещества, содержание которых увеличено в крови у таких пациентов
г) Объясните токсическое действие одного из этих веществ на нервные клетки
б) Орнитиновый цикл в печени выполняет 2 функции:
1. Превращение азота аминокислот в мочевину, которая экскретируется ми предотвращает накопление токсичных продуктов, главным образом аммиака
2. Синтез аргинина и пополнение его фонда в орагнизме
в) Может увеличиться концентрация аммиака, карбомоилфосфата, цитрулина, аргининосукцината.
г) Механизм токсического действия аммиака на мозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем.
• Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата:
а-Кетоглутарат + NADH + Н + + NH3 → Глутамат + NAD + .
Уменьшение концентрации а-кетоглутарата вызывает:
угнетение обмена аминокислот (реакции трансаминирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.); гипоэнергетическое состояние в результате снижения скорости ЦТК.
Недостаточность а-кетоглутарата приводит к снижению концентрации метаболитов ЦТК, что вызывает ускорение реакции синтеза оксалоацетата из пирувата, сопровождающейся интенсивным потреблением СО2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга.
• Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону (вызывает алкалоз). Это, в свою очередь, увеличивает сродство гемоглобина к кислороду, что приводит к гипоксии тканей, накоплению СО2 и гипоэнергетическому состоянию, от которого главным образом страдает головной мозг.
• Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3РО4.
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга. Снижение концентрации глутамата нарушает обмен аминокислот и нейромедиаторов, в частности синтез γ-аминомаслянной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
• Ион NH4 + практически не проникает в цитоплазматические и митохондриальные мембраны. Избыток иона аммония в крови способен нарушать трансмембранный перенос одновалентных катионов Na + и К + , конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульса.
Otvety_na_ekzamenatsionnye_zadachi_iz_zadachnika (2)
№ 9.2 При наследственном заболевании аргининосукцинутрии суточная экскреция аргининосукцината почками достигает 3 г (в норме отсутствует). Укажите возможную причину и проявления этого заболевания. Для этого:
в) Перечислите вещества, содержание которых повышено в крови данного больного
Проявления отравления аммиаком: снижается проведение нервного импульса, так ионы NH4 похожи на ионы натри; снижение активности Na/K Атфазы, снижение скорости ЦТК, снижение скорости обмена аминокислот, снижение количества АТФ, и, как следствие, гипоэнергетическое состояние, снижение активности тормозных медиаторов, накопление глутамина в нервных клетках приводит к увеличению осмотического давления, что приводит к задержке воды и следовательно, отёк мозга.
в) Идёт накопление аммиака, карбамоилфосфата, цитрулина, аргининосукцината
№ 9.3 Объясните, каковы причины повторяющейся рвоты, припадков с потерей сознания ребенка в возрасте 4 мес, если в крови обнаружена высокая концентрация цитруллина:
а) Ответ проиллюстрируйте схемой нарушенного процесса, указав место ферментативного блока
б) Объясните механизмы развития перечисленных симптомов
в) Почему состояние больного улучшается при назначении малобелковой диеты
Причина – цитрулинемия, дефект фермента аргининосукцинатсинтетазы.
б) Снижении активности фермента аргининосукцинатсинтетазы приводит к накоплению в крови цитрулина и его предшественников. Повышается концентрация аммиака, карбомоилфосфата.
в) При малобелковой диете в организм поступает меньше аминокислот, а следовательно уменьшается количество аммиака.
№ 9.4 Пациенты с наследственными нарушениями орнитинового цикла избегают белковой пищи, у них отмечаются приступы рвоты, сонливость, судорожные припадки и умственная отсталость. Выскажите предположения о причинах наблюдаемых явления. Для этого:
в) Перечислите вещества, содержание которых увеличено в крови у таких пациентов
г) Объясните токсическое действие одного из этих веществ на нервные клетки
б) Орнитиновый цикл в печени выполняет 2 функции:
1. Превращение азота аминокислот в мочевину, которая экскретируется ми предотвращает накопление токсичных продуктов, главным образом аммиака
2. Синтез аргинина и пополнение его фонда в орагнизме
в) Может увеличиться концентрация аммиака, карбомоилфосфата, цитрулина, аргининосукцината.
г) Механизм токсического действия аммиака на мозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем.
• Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата:
а-Кетоглутарат + NADH + Н + + NH3 → Глутамат + NAD + .
Уменьшение концентрации а-кетоглутарата вызывает:
угнетение обмена аминокислот (реакции трансаминирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.); гипоэнергетическое состояние в результате снижения скорости ЦТК.
Недостаточность а-кетоглутарата приводит к снижению концентрации метаболитов ЦТК, что вызывает ускорение реакции синтеза оксалоацетата из пирувата, сопровождающейся интенсивным потреблением СО2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга.
• Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону (вызывает алкалоз). Это, в свою очередь, увеличивает сродство гемоглобина к кислороду, что приводит к гипоксии тканей, накоплению СО2 и гипоэнергетическому состоянию, от которого главным образом страдает головной мозг.
• Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3РО4.
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга. Снижение концентрации глутамата нарушает обмен аминокислот и нейромедиаторов, в частности синтез γ-аминомаслянной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
• Ион NH4 + практически не проникает в цитоплазматические и митохондриальные мембраны. Избыток иона аммония в крови способен нарушать трансмембранный перенос одновалентных катионов Na + и К + , конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульса.
1. Синтез и секреция катехоламинов
Синтез катехоламинов происходит в цитоплазме и гранулах клеток мозгового слоя надпочечников (рис. 11-22). В гранулах происходит также запасание катехоламинов.
Катехоламины поступают в гранулы путём АТФ-зависимого транспорта и хранятся в них в комплексе с АТФ в соотношении 4:1 (гормон-АТФ). Разные гранулы содержат разные катехоламины: некоторые только адреналин, другие — норадреналин, третьи — оба гормона.
Секреция гормонов из гранул происходит путём экзоцитоза. Катехоламины и АТФ освобождаются из гранул в том же соотношении, в каком они сохраняются в гранулах. В отличие от симпатических нервов, клетки мозгового слоя надпочечников лишены механизма обратного захвата выделившихся катехоламинов.
В плазме крови катехоламины образуют непрочный комплекс с альбумином. Адреналин транспортируется в основном к печени и скелетным мышцам. Норадреналин образуется в основном в органах, иннервируемых симпатическими нервами (80% от общего количества). Норадреналин лишь в незначительных количествах достигает периферических тканей. Т1/2катехоламинов — 10-30 с. Основная часть катехоламинов быстро метаболизируется в различных тканях при участии специфических ферментов (см. раздел 9). Лишь небольшая часть адреналина (
2. Механизм действия и биологические функции катехоламинов
Катехоламины действуют на клетки-мишени через рецепторы, локализованные в плазматической мембране. Выделяют 2 главных класса таких рецепторов: α-адренергические и β-адренергические. Все рецепторы катехоламинов — гликопротеины, которые являются продуктами разных генов, различаются сродством к агонистам и антагонистам и передают сигналы в клетки с помощью разных вторичных посредников. Это определяет характер их влияния на метаболизм клеток-мишеней.
Рис. 11-22. Синтез и секреция катехоламинов.Биосинтез катехоламинов происходит в цитоплазме и гранулах клеток мозгового слоя надпочечников. В одних гранулах содержится адреналин, в других норадреналин, а в некоторых — оба гормона. При стимуляции содержимое гранул высвобождается во внеклеточную жидкость. А — адреналин; НА — норадреналин.
Адреналин взаимодействует как с α-, так и с β-рецепторами; норадреналин в физиологических концентрациях главным образом взаимодействует с α-рецепторами.
Взаимодействие гормона с β-рецепторами активирует аденилатциклазу, тогда как связывание с α2-рецептором её ингибирует. При взаимодействии гормона с α1-рецептором происходит активация фосфолипазы С и стимулируется инозитолфосфатный путь передачи сигнала (см. раздел 5).
Биологические эффекты адреналина и норадреналина затрагивают практически все функции организма и рассматриваются в соответствующих разделах. Общее во всех этих эффектах заключается в стимуляции процессов, необходимых для противостояния организма чрезвычайным ситуациям.
3. Патология мозгового вещества надпочечников
Основная патология мозгового вещества надпочечников — феохромоцитома, опухоль, образованная хромаффинными клетками и продуцирующая катехоламины. Клинически феохромоцитома проявляется повторяющимися приступами головной боли, сердцебиения, потливости, повышением АД и сопровождается характерными изменениями метаболизма (см. разделы 7,8).
Ж. Гормоны поджелудочной железы и желудочно-кишечного тракта ТРАКТА
Поджелудочная железа выполняет в организме две важнейшие функции: экзокринную и эндокринную. Экзокринная функция обеспечивает синтез и секрецию ферментов и ионов, необходимых для процессов пищеварения. Эндокринную функцию выполняют клетки островкового аппарата поджелудочной железы, которые секретируют гормоны, участвующие в регуляции многих процессов в организме.
В островковой части поджелудочной железы (островки Лангерханса) выделяют 4 типа клеток, секретирующих разные гормоны: А- (или α-) клетки секретируют глюкагон, В- (или β-) — инсулин, D- (или δ-) — соматостатин, F-клетки секретируют панкреатический полипептид.
Параграф 105 катехоламины 1
Автор текста – Анисимова Елена Сергеевна. Авторские права защищены.
Курсив НЕ НУЖНО зубрить.
Замечания и отзывы можно прислать по почте exam_bch@mail.ru
https://vk.com/bch_5
ПАРАГРАФ 105: «Катехоламины»
105. 1. Определение катехоламинов.
105. 2. Отделы симпатико-адреналовой системы (САС).
105. 3. Функции симпатико-адреналовой системы:
105. 4. Защитное и патогенное действие катехоламинов.
105. 5. Причинами дефицита катехоламинов могут быть: …
105. 6. Причины избытка эффектов катехоламинов: …
105. 7. Синтез катехоламинов.
105. 8. Депонирование катехоламинов.
Как происходит поступление молекул катехоламинов в везикулы?
Создание низкого рН в везикулах.
105. 9. Освобождение катехоламинов. (Секреция).
Как происходит секреция катехоламинов? (ЭКЗОЦИТОЗ)
Секреция катехоламинов регулируется гормонами.
105. 10. Что происходит после секреции катехоламинов в синапсы:
I. Молекулы катехоламинов действуют на клетку-мишень:
II. Диффузия в кровь.
III. Действие катехоламинов на секретировавшую их клетку.
(аутоингибирование)
IV. Обратный захват (из синапсов)
V. Инактивация катехоламинов ферментами в нейронах.
VI. После секреции катехоламинов в кровь:
VII. Метаболизм катехоламинов.
(см. выше «инактивация катехоламинов ферментами в нейронах).
Где происходит инактивация катехоламинов? –
105. 1. Определение катехоламинов.
Катехоламины – это группа гормонов, к которой относятся ДОФАМИН, НОРАДРЕНАЛИН И АДРЕНАЛИН.
Но часто, говоря, «катехоламины», имеют в виду только норадреналин и адреналин.
Клетки и органы, которые вырабатываются катехоламины,
называют симпатико-адреналовой системой (САС)
(потому что к ней относятся симпатические нервы, адреналин,
но не только они – см. далее).
В САС выделяют отделы:
105. 2. Отделы симпатико-адреналовой системы (САС).
Определение САС:
Симпатико-адреналовой системой называют клетки и органы,
которые вырабатывают катехоламины:
головной мозг, симпатические нервы и мозговое вещество надпочечников.
Адреналин
синтезируется и секретируется мозговым веществом надпочечников,
секретируется в кровь.
Норадреналин
синтезируется нервными клетками, секретируется в синапсы,
а также секретируется окончаниями симпатических нервов,
поступая в итоге в кровь благодаря диффузии.
Дофамин
синтезируется нервными клетками, кишечником, сосудами и почками,
секретируется в кровь и синапсы (из нервных клеток).
Повреждение названных органов и клеток
может стать причиной дефицита катехоламинов и соответствующих симптомов.
Например, повреждения ряда клеток головного мозга приводит к дефициту дофамина в те синапсах, дефицит в которых приводит к паркинсонизму.
Отделы симпатико-адреналовой системы:
1. Нервные клетки, вырабатывающие катехоламины,
относятся к ЦЕНТРАЛЬНОМУ отделу САС.
В центральном отделе вырабатываются ДОФАМИН И НОРАДРЕНАЛИН
(но они вырабатываются и в других отделах).
2. Симпатические нервы относят к СИМПАТИЧЕСКОМУ отделу САС,
он вырабатывает НОРАДРЕНАЛИН.
3. Мозговое вещество надпочечников относят к ПЕРИФЕРИЧЕСКОМУ отделу САС.
Он вырабатывает АДРЕНАЛИН.
Таблица «Отделы симпатико-адреналовой системы».
гормоны Где синтезируется гормон Куда секретируется из синтезирующих клеток Отдел симпатико-адреналовой системы Куда поступает гормон для метаболизма
Дофамин В кишечнике, почках, сосудах В кровь В печень
В нервных клетках В синапсы Центральный
отдел САС В нервные
клетки (в них фермент МАО)
норадреналин В нервных клетках
головного мозга В нервные клетки (МАО)
В окончаниях симпатических нервов В синапсы,
из которых затем
норадреналин
диффундирует
в кровь Симпатический
отдел САС В печень
(в её клетках есть фермент
КОМТ для инактивации КА
В мозговом веществе надпочечников (немного) В кровь Периферический
отдел САС
адреналин В мозговом веществе надпочечников
105. 3. Функции симпатико-адреналовой системы:
выработка катехоламинов, которые, в свою очередь, участвуют в:
1 – в поддержании гомеостаза:
гомеостатическая функция САС,
2 – в адаптации организма к меняющимся условиям окружающей среды:
адаптационная функция САС,
3 – в поддержке функций организма при стрессах:
эмоциональных, болевых, при травмах, инфекциях и т.д.:
аварийная функция САС.
Функция САС – выработка и секреция катехоламинов.
Функции катехоламинов иногда относят к функциям САС.
105. 4. Защитное и патогенное действие катехоламинов.
Значение катехоламинов в патогенезе заключается в том,
что и избыток, и дефицит катехоламинов приводит к заболеваниям.
Патогенное действие катехоламинов проявляется в том, что
их избыток приводит к заболеваниям.
Например:
Дефицит норадреналина и дофамина может привести к ДЕПРЕССИИ,
(поэтому действие ряда антидепрессантов направлено на
повышение количества этих катехоламинов в синапсах головного мозга).
Избыток адреналина и норадреналина
(причинами которого является опухоли мозгового вещества надпочечников
или частые стрессы)
ПОВРЕЖДАЕТ СЕРДЦЕ (приводит к «утолщению» сердца – гипертрофии),
и СОСУДЫ, способствует атеросклерозу и развитию хронической сердечной недостаточности.
В норме катехоламины помогают организму выжить
при повышенных нагрузках,
стрессах, голоде, переохлаждении и т.д.
И справиться с задачами. Мобилизоваться для решения задач.
В основном за счёт повышения выработки энергии в клетках – АТФ и тепла.
О способах повышения выработки энергии в клетках – п.106.
105. 5. Причины дефицита катехоламинов:
Причинами дефицита катехоламинов (как и всех гормонов) могут быть:
1) МУТАЦИИ ГЕНОВ, кодирующих:
1.1. ферменты синтеза катехоламинов (п. 57, 76),
1.2. рецепторы катехоламинов и белки их СТС (п.92),
2) недостаточная активность клеток, вырабатывающих катехоламины, из-за повреждения клеток инфекциями, ядами и т.д.
3) – НАРУШЕНИЕ РЕГУЛЯЦИИ синтеза или секреции катехоламинов.
105. 6. Причины избытка эффектов катехоламинов:
1) повышенный синтез из-за повышенной активности ферментов
(из-за мутаций их генов) или из-за повышенной стимуляции синтеза,
2) повышенная активность рецепторов катехоламинов или белков их СТС (п.92),
3) замедленное поступление катехоламинов в клетки
из-за сниженной активности белков-транспортёров
(например, белков обратного захвата),
4) сниженная активность ферментов, которые должны инактивировать катехоламины – МАО и КОМТ (см. далее),
5) повышенная стимуляция синтеза или секреции катехоламинов.
105. 7. Синтез катехоламинов.
(См. п.68 и 63, файл «105 ТАБЛИЦЫ»)
Катехоламины синтезируются из аминокислоты ТИРОЗИН
при участии 4 ферментов и 5 витаминов: РР, В6, С, В12 и фолата.
Дефицит этих витаминов может стать
причиной снижения синтеза катехоламинов и дефицита катехоламинов,
а включение в пищу этих витаминов может улучшить синтез катехоламинов.
Источники тирозина (п.68):
1) расщепление белков пищи или белков организма,
2) синтез из аминокислоты фенилаланин,
которую организм тоже получает при расщеплении белков пищи или белков организма.
Превращение фенилаланина в тирозин (синтез тирозина) происходит
в результате присоединения одного атома кислорода,
в результате которого образуется гидроксильная (ОН) группа.
Эта реакция называется гидроксилированием фенилаланина,
катализируется ферментом фенилаланин/гидроксилазой,
требует участия кофакторов:
НАДФН (и витамина РР в его составе) и тетра/гидро/биопрерин (ТГБП).
При нарушении этой реакции
(из-за дефекта фермента
или отсутствия кофакторов,
в том числе из-за дефицита витамина РР)
проблемы возникают не из-за отсутствия тирозина
(так как тирозин можно получить при распаде белков),
а из-за избытка фенилаланина (см. п. 68).
Превращение тирозина в катехоламины.
1-я реакция синтеза катехоламинов:
превращение тирозина в ДОФА (ДигидрОксиФенилАланин)
в результате присоединения одного атома кислорода,
в результате которого образуется вторая ОН (гидроксильная) группа.
Реакция называется гидроксилированием тирозина,
катализируется ферментом, который называется гидроксилазой тирозина или тирозин/гидроксилазой.
Нужен кофермент НАДФН с витамином РР в его составе.
Реакция похожа на гидроксилирование фенилаланина.
2-я реакция синтеза катехоламинов (см. п.63):
превращение ДОФА в дофамин
в результате отщепления СОО атомов карбоксильной группы ДОФА.
Реакция называется декарбоксилированием ДОФА
и катализируется ферментом, который называется декарбоксилазой ДОФА
или ДОФА/декарбоксилазой.
Для реакции нужен витамин В6 в составе кофермента пиридоксаль/фосфата.
Дефицит в пище витамина В6
может привести к снижению скорости этой реакции
и вследствие этого дефициту дофамина и других катехоламинов,
а включение В6 в рацион (продуктов с В6: орехов, печени, яиц, бобовых, рыбы)
может повысить синтез дофамина
и повысить количество дофамина,
предотвратить следствия дефицита дофамина
(скуку, равнодушие, дефицит интереса к жизни и т.д.).
Не путать ДОФА и дофамин:
у ДОФА есть СОО атомы, которых нет у дофамина.
Синтез дофамина на этом заканчивается.
Но в симпатических нервах и мозговом веществе надпочечников есть ферменты, которые превращают дофамин в другие катехоламины.
3-я реакция синтеза катехоламинов:
превращение дофамина в норадреналин
в результате присоединения одного атома кислорода,
в результате чего образуется ОН (гидроксильная) группа.
Реакция называется гидроксилированием дофамина
и катализируется ферментом, который называется гидроксилазой дофамина
или дофамин/гидроксилазой.
Для работы этого фермента (и протекания этой реакции)
нужен витамин С (аскорбат).
Дефицит в пище витамина С может привести к снижению скорости этой реакции
и дефициту норадреналина и адреналина,
а включение витамина С в рацион (продуктов с С: шиповника, капусты и т.д. – см. п.17)
может повысить синтез норадреналина
и повысить количество норадреналина,
предотвратить следствия дефицита норадреналина
(рассеянность, невнимательность, снижение памяти и т.д.).
4-я реакция (есть только в мозговом веществе надпочечников):
превращение норадреналина в адреналин
в результате присоединения метильной группы (-СН3) к норадреналину.
Способ присоединения метильной группы – перенос от SAM:
S-аденозиЛ/метионина (основного источника метильных групп),
то есть трансметилирование (см. п. 68).
Реакция называется метилированием норадреналина,
и катализируется ферментом, который называется переносчиком метила на норадреналин:
норадреналин/метил/трансферазой.
Чтобы реакция протекала с нужной скоростью
и давала нужное количество адреналина,
нужно достаточное количество SAM,
а для этого в пище должно быть много метионина или витаминов В12 и фолат – см. п.68.
105. 8. Депонирование катехоламинов.
После синтеза молекулы катехоламинов накапливаются в ВЕЗИКУЛАХ
(пузырьках, окружённых мембраной, секреторных гранулах),
в которых хранятся до тех пор, пока не понадобится секреция данного катехоламина.
Эти везикулы выполняют функцию запасных депо катехоламинов.
Депонирование – это накопление катехоламинов в везикулах-депо.
Как происходит поступление молекул катехоламинов в везикулы?
Молекулы катехоламинов поступают внутрь «пузырьков» (секреторных гранул)
с помощью специальных белков,
против градиента концентрации катехоламинов.
Создание низкого рН в везикулах.
Внутри везикул создаётся кислая среда (низкий рН, высокая концентрация протонов Н+)
за счёт транспорта протонов (Н+)
в везикулы из гиалоплазмы
через мембрану везикул
специальными транспортными белками
против градиента концентрации протонов.
(То есть происходит активный транспорт протонов).
Источником энергии для транспорта протонов в везикулы
является расщепление АТФ.
Белки, которые осуществляют транспорт протонов против градиента протонов,
называются протонными АТФ-азами или протонными помпами.
105. 9. Освобождение катехоламинов. (Секреция).
Говоря «освобождение катехоламинов», имеют в виду
выделение (секрецию) молекул (секрецию молекул) катехоламинов
из синтезировавших их клеток в синапс или в кровь.
Как происходит секреция катехоламинов? (ЭКЗОЦИТОЗ)
Везикулы с молекулами катехоламинов (в которых они депонируются)
перемещаются к ципоплазматической мембране, и их мембрана сливается с цитоплазматической мембраной (липиды мембраны везикул встраиваются в цитоплазматическую мембрану). В результате слияния мембран содержимое везикул оказывается вне клетки (в данном случае молекулы катехоламинов).
Такой способ поступления веществ из клетки во внеклеточную среду
Называется ЭКЗОЦИТОЗОМ.
Перемещение везикул к цитоплазматической мембране происходит
с участием ионов кальция (п.114) и белков цитоскелета, в том числе с участием актина.
Если секреция происходит в синапс, то участок цитоплазматической мембраны, в котором происходит секреция катехоламинов, называется пресинаптической мембраной.
Секреция катехоламинов регулируется гормонами.
Благодаря регуляции секреции данный катехоламин секретируется
(поступает в кровь или синапс)
тогда, когда данный катехоламин нужен в синапсе или в крови.
Сигналом для секреции катехоламинов является
связывание определённого вещества (нейрогормона, нейромедиатора – см. п.91)
с рецепторами, находящимися на мембране секретирующей клетки
(на пресинаптической мембране).
Гормоны, регулирующие секрецию катехоламинов,
в свою очередь тоже секретируются другими клетками.
Нарушение регуляции катехоламинов секреции может стать причиной дефицита или избытка катехоламинов и соответствующих симптомов.
105. 10. Что происходит после секреции катехоламинов в синапсы:
I. Молекулы катехоламинов действуют на клетку-мишень:
1) молекулы катехоламинов
диффундируют в пространстве синапса к мембране другой клетки
(эта мембрана называется постсинаптической) – клетке-МИШЕНИ;
2) достигнув постсинаптической мембраны,
молекулы катехоламинов связываются со своими рецепторами,
расположенными на поверхности постсинаптической мембраны клетки-мишени;
3) связывание катехоламинов со своими рецепторами на постсинаптической мембране
приводит к изменению процессов в клетке-мишени
(в той клетке, на цитоплазматической мембране которой находятся рецепторы).
При этом наблюдается паракринное действие катехоламинов – п.91.
Изменение процессов в клетках является
ответом клетки на связывание гормонов с рецепторами.
В этом же изменении процессов заключается и эффект гормона.
Какие эффекты катехоламинов возникают при связывании катехоламинов со своими рецепторами – в п.106.
Из синапсов молекулы катехоламинов могут ДИФФУНДИРОВАТЬ В КРОВЬ:
основное количество норадреналина в крови –
это молекулы норадреналина, которые диффундировали в кровь из синапсов,
в которые были секретирован окончаниями симпатических нервов.
В крови норадреналин является дистантным гормоном,
проявляет эндокринное действие – см. п.106.
III. Действие катехоламинов на секретировавшую их клетку.
(аутоингибирование)
Молекулы катехоламинов могут связываться с рецепторами,
расположенными на мембране секретировавшей их клетки
(то есть на пресинаптической мембране).
Обычно это приводит к СНИЖЕНИЮ ДАЛЬНЕЙШЕЙ СЕКРЕЦИИ катехоламинов, что
1) предотвращает накопление в синапсе
избыточного количества катехоламинов
2) и предотвращает «истощение» секретирующей клетки,
3) а также предотвращает избыточное действие катехоламинов на клетки-мишени.
Это явление снижения секреции гормона
под действием этого же гормона
называется «самоторможением» или АУТОИНГИБИРОВАНИЕМ.
Рецепторы, через которые молекулы норадреналина
снижают секрецию других молекул норадреналина,
называются ;2 (альфа-два) адренорецепторами.
При аутоингибировании проявляется аутокринное действие катехоламинов:
то есть действие, когда гормон влияет на ту же клетку, которая его секретировала.
Блокада ;2-рецепторов привела бы к тому, что скорость секреции катехоламинов не снизилась бы,
что привело бы к повышению количества катехоламина в синапсе.
IV. Обратный захват (из синапсов)
Молекулы катехоламинов могут поступать обратно
в секретировавшую их клетку –
этот процесс называется ОБРАТНЫМ ЗАХВАТОМ.
Обратный захват осуществляется определёнными белками,
которые переносят молекулы катехоламинов
через пресинаптическую мембрану
с внешней стороны мембраны на внутреннюю.
После обратного захвата
молекулы катехоламинов снова «закачиваются» в везикулы,
как и новосинтезированные молекулы катехоламинов,
то есть депонируются.
Это даёт возможность синтезировать меньше катехоламинов,
то есть позволяет клетке экономить.
Но часть молекул катехоламинов разрушается – см. далее.
Кроме того, обратный захват помогает
1) предотвратить накопление в синапсе
избыточного количества катехоламинов
2) и предотвратить «истощение» секретирующей клетки,
3) а также предотвратить избыточное действие катехоламинов на клетки-мишени (так как их меньше становится в синапсе)
Как и все белки, белки, осуществляющие обратный захват,
можно ингибировать определёнными веществами-ингибиторами
и тем самым снижать скорость обратного захвата.
Снижение скорости обратного захвата
приводит к повышению концентрации катехоламинов в синапсе,
повышает вероятность связывания катехоламинов с рецепторами постсинаптической мембраны клетки-мишени,
усиливает эффекты катехоламинов, в том числе те эффекты, которые снижают депрессию.
Ингибиторы обратного захвата применяются
при лечении некоторых эндогенных депрессий –
см. файл «99 БИОХИМИЯ СЧАСТЬЯ ПРИЛОЖЕНИЕ».
V. Инактивация катехоламинов ферментами в нейронах.
После обратного захвата часть молекул катехоламинов
подвергается действию фермента, которые называется моноамин/оксидазой (МАО).
Реакции МАО относят к метаболизму катехоламинов.
В результате действия МАО образуются вещества,
не способные вызывать те эффекты, которые вызывают катехоламины,
поэтому говорят, что
метаболизм катехоламинов приводит к инактивации катехоламинов,
то есть к потере активности к молекул бывших катехоламинов.
Ингибирование МАО (ингибиторами МАО) приводит
к снижению скорости реакций инактивации катехоламинов.
Это, как и ингибирование белков обратного захвата,
приводит к повышению концентрации катехоламинов в синапсах
и снижению симптомов эндогенных депрессий.
Упрощённо говоря, фермент МАО – депрессант (фактор, ведущий к депрессии),
а ингибиторы МАО (как и ингибиторы обратного захвата) – антидепрессанты.
Витамин В1 тоже ингибирует МАО – это одна из причин,
по которым В1 препятствует депрессии (является антидепрессантом).
И одна из причин того, что дефицит витамина В1 приводит к депрессии – п.11.
VI. После секреции катехоламинов в кровь:
молекулы катехоламинов транспортируются
с током крови к разным органам,
связываются на мембранах клеток разных органов
со своими рецепторами,
что приводит к возникновению эффектов катехоламинов.
Рецепторы катехоламинов есть на мембранах большинства клеток,
поэтому катехоламины относят к гормонам универсального действия.
Катехоламины могут быть:
1) дистантными гормонами,
2) нейрогормонами (дофамин и норадреналин),
3) местными гормонами.
Могут участвовать:
1) в нейрокринной регуляции,
2) нейрокринной,
3) паракринной и
4) аутокринной (см. аутоингибирование) – п. 91.
VII. Метаболизм катехоламинов.
(см. выше «инактивация катехоламинов ферментами в нейронах).
Метаболизм катехоламинов – это реакции,
в которые вступают катехоламины (уже после своего синтеза).
В результате этих реакций катехоламины превращаются в неактивные вещества,
то есть метаболизм приводит к инактивации катехоламинов
и именно для этой инактивации и нужен.
Значение метаболизма катехоламинов –
оно инактивирует катехоламины,
что позволяет организму быстро снизить концентрацию катехоламинов
в крови или синапсах,
что предотвращает избыточное влияние катехоламинов на организм,
в том числе предотвращает патогенное действие катехоламинов:
например, защищает сердце от повреждения катехоламинами.
Где происходит инактивация катехоламинов? –
1) в клетках, которые синтезируют катехоламины – после обратного захвата
(см. выше), под действием фермента МАО – см. выше;
2) в клетках ПЕЧЕНИ под действием фермента КОМТ,
который переносит метильную группу на молекулы катехоламинов (на атом кислорода)
и поэтому называется Катехол-О-Метил-Трансферазой.
Источником метильной группы для фермента КОМТ
(как и при большинстве процессов (транс)метилирования)
является аминокислота МЕТИОНИН (п.68),
соединенная с аденозилом – S/аденозил/метионин = SAM,
то есть активная форма метионина.
Для поддержания концентрации SAM нужны витамины фолат и В12.
Поэтому достаточное количество метионина, витаминов фолата и В12 в пище
способствует своевременной инактивации катехоламинов
и защищает организм от вреда катехоламинов.