Гипофосфатемический витамин-D-резистентный рахит
Семейный гипофосфатемический рахит, или фосфат-диабет, или витамин-D-резистентный рахит (HYPOPHOSPHATEMIC VITAMIN D-RESISTANT RICKETS; HPDR; 307800), впервые описал Albrigt и соавт. в 1937г. Х-сцепленный гипофосфатемический рахит – наиболее распространенная форма гипофосфатемии, с частотой встречаемости около 1 на 20000-25000.
Причины гипофосфатемического рахита
Заболевание имеет Х-сцепленный доминантный тип наследования. Характеризуется полной пенетрантностью для гипофосфатемии и неполной — для костных изменений. Женщины передают патологический признак дочерям и сыновьям c вероятностью 50%, мужчины — только дочерям с вероятностью 100%. У мальчиков болезнь протекает тяжелее, чем у девочек.
Молекулярно-генетическая причина заболевания – мутации в гене PHEX (Phosphat regulating hormone with homologies to endopeptidases on the X-chromosome). Ген состоит из 18 экзонов и кодирует фосфат-регулирующую эндопептидазу (гомологичную нейтральным эндопептидазам, которые регулируют активность других протеинов), контролирующую мембранный транспорт фосфата в почечных канальцах, тонкой кишке и, возможно, в других органах. Каким образом мутации в гене PHEX через гипотетический фосфатурический гормон приводят к почечной потере фосфата и нарушениям обмена витамина D, еще остается неясным и мнения по этому вопросу весьма противоречивы. Гипотетическая модель: предполагается, что эндопептидаза PHEX обуславливает активацию фосфатуритического гормона. Если мутация в PHEX-гене приводит к потере активности эндопептидазы, то вследствие этого снижается активность фосфатонина и, в итоге, возникает потеря фосфата через почки и отсутствие подавления инактивации 1,25-(OH)3-витамин-D.
Диагностика
Генетический дефект приводит к нарушениям реабсорбции фосфата в канальцах почек и его всасывания в тонкой кишке. Проявляется это гиперфосфатурией, гипофосфатемией, повышением активности щелочной фосфатазы и развитием рахитоподобных изменений, не поддающихся лечению витамином D в обычных дозах. Гипокальциемии (недостатка кальция) нет или она незначительна. Концентрация азотистых шлаков и электролитов в крови нормальная. Другие парциальные функции почек нормальные. Уровень цитратов в крови нормальный, в противоположность гипоцитратемии при обычном витамин-D-дефицитном рахите.
На рентгенограмме костей выявляются значительные изменения в эпи- и метафизарных зон. Структура диафизов отличается от таковой при обычном рахите: наряду с зонами роста имеются зоны остеосклероза. Наблюдается утолщение трубчатых костей за счет одностороннего, чаще медиального слоя периоста.
Симптомы гипофосфатемического рахита
Заболевание начинается в конце первого или начале второго года жизни. У больных детей наблюдается мышечная гипотония, варусные деформации костей, особенно нижних конечностей, рахитические “браслеты”, “четки”, нарушение походки — “утиная” походка, отставание в росте. Иногда наблюдаются спонтанные переломы. Зубы прорезываются нормально, но быстро поражаются кариесом. Психическое развитие не страдает.
После закрытия эпифизарных зон роста проявления болезни ослабевают, но у нелеченных больных в зрелом возрасте встречаются тяжелые поражения костей.
У взрослых наследственная гипофосфатемия может сочетаться с остеомаляцией. Клинически она проявляется болью в костях, мышечной слабостью, уменьшением роста из-за сжатия позвонков. Уровень кальция в крови не нарушается, но имеется отрицательный кальций-фосфорный баланс.
Лечение гипофосфатемического рахита
Еще не существует никакой удовлетворительной терапии гипофосфатемического рахита.
Медикаментозное лечение не влияет на в основе лежащий генетический дефект, однако, при нем достигается клиническое излечение рахита и улучшение гистологии костей. Лечение должно начинаться как можно раньше, чтобы можно было избежать деформации костей. Необходимые дозировки зависят от выраженности рахита и от возраста пациента. Выше они у маленьких детей (или в начале терапии и у детей более старшего возраста), затем уменьшаются, чтобы во время скачка роста во время пубертата снова увеличиться.
При наследственном гипофосфатемическом витамин D-резистентном рахите имеется резко выраженная толерантность к препаратам эргокальциферола. Назначение их в дозах, соответствующих физиологической потребности или применяемых для лечения рахита, обусловленного дефицитом витамина Д, не приводит ни к повышению содержания фосфатов в крови, ни к уменьшению симптомов рахита или остеомаляции.
Поэтому для лечения фосфатдиабета приходится использовать препараты в больших дозах (в среднем по 30 000—100 000 ME и более в сутки). Различий в эффективности холекальциферола и эргокальциферола при этом заболевании не выявлено. Вместо этих средств можно назначить дигидротахистерин по 0,5—1,5 мг в день. По химической структуре последний близок к эргокальциферолу.
Под влиянием больших доз эргокальциферола или дигидротахистерина усиливается всасывание кальция в кишечнике, улучшается баланс кальция и фосфора, уменьшается активность щелочной фосфатазы, по-видимому, вследствие ингибирующего действия больших доз этих препаратов. В связи с этим явления рахита и остеомаляция затихают. Тем не менее экскреция (выделение) фосфатов с мочой не уменьшается. Поэтому уровень их в крови остается сниженным, но рост больных при этом нормализуется.
Прогноз и осложнения
После пубертатного периода заболевание может проходить даже без лечения. У взрослых, перенесших в детстве витамин-D-резистентный рахит, сохраняется гипофосфатемия, низкорослость, пострахитические деформации конечностей таза, часто обусловливающие кесарево сечение у женщин. Рецидивы возможны в период напряжения минерального обмена (беременность, лактация).
Гипофосфатемический рахит
Наша команда профессионалов ответит на ваши вопросы
Гипофосфатемические рахиты (hypophosphatemic rickets, HR) – генетически гетерогенная группа заболеваний с различными типами наследования, причиной развития которых могут быть мутации в ряде генов. Выделяют аутосомно-доминантную форму: ADHR (193100), обусловленную мутациями в гене FGF23 (12p13.32; 605380) ; аутосомно-рецессивные формы: ARHR1 (241520), обусловленную мутациями в гене DMP1, (4q21; 600980), и ARHR2 (613312), обусловленную мутациями в гене ENPP1 (6q22-q23; 173335); Х-сцепленную доминантную форму (307800), обусловленную мутациями в гене PHEX (Xp22.11; 300550); Х-сцепленную рецессивную форму (300554), обусловленную мутациями в гене CLCN5 (Xp11.23; 300008).
Семейный гипофосфатемический рахит, или фосфат-диабет, или витамин-D-резистентный рахит (HYPOPHOSPHATEMIC VITAMIN D-RESISTANT RICKETS; 307800), впервые описал Albrigt и соавт. в 1937г. Заболевание имеет Х-сцепленный доминантный тип наследования. Характеризуется полной пенетрантностью для гипофосфатемии и неполной — для костных изменений. Женщины передают патологический признак дочерям и сыновьям c вероятностью 50%, мужчины — только дочерям с вероятностью 100%. У мальчиков болезнь протекает тяжелее, чем у девочек.
Х-сцепленный гипофосфатемический рахит – наиболее распространенная форма гипофосфатемии, с частотой встречаемости около 1 на 20000-25000.
Молекулярно-генетическая причина заболевания – мутации в гене PHEX (Phosphat regulating hormone with homologies to endopeptidases on the X-chromosome). Ген состоит из 18 экзонов и кодирует фосфат-регулирующую эндопептидазу (гомологичную нейтральным эндопептидазам, которые регулируют активность других протеинов), контролирующую мембранный транспорт фосфата в почечных канальцах, тонкой кишке и, возможно, в других органах. Каким образом мутации в гене PHEX через гипотетический фосфатурический гормон приводят к почечной потере фосфата и нарушениям обмена витамина D, еще остается неясным и мнения по этому вопросу весьма противоречивы. Гипотетическая модель: предполагается, что эндопептидаза PHEX обуславливает активацию фосфатуритического гормона. Если мутация в PHEX-гене приводит к потере активности эндопептидазы, то вследствие этого снижается активность фосфатонина и, в итоге, возникает потеря фосфата через почки и отсутствие подавления инактивации 1,25-(OH)3-витамин-D.
Генетический дефект приводит к нарушениям реабсорбции фосфата в канальцах почек и его всасывания в тонкой кишке.
Заболевание начинается в конце первого или начале второго года жизни. У больных детей наблюдается мышечная гипотония, варусные деформации костей, особенно нижних конечностей, рахитические “браслеты”, “четки”, нарушение походки — “утиная” походка, отставание в росте. Иногда наблюдаются спонтанные переломы. Зубы прорезываются нормально, но быстро поражаются кариесом. Психическое развитие не страдает. На рентгенограмме костей выявляются значительные изменения в эпи- и метафизарных зон. Структура диафизов отличается от таковой при обычном рахите: наряду с зонами роста имеются зоны остеосклероза. Наблюдается утолщение трубчатых костей за счет одностороннего, чаще медиального слоя периоста. После закрытия эпифизарных зон роста проявления болезни ослабевают, но у нелеченных больных в зрелом возрасте встречаются тяжелые поражения костей.
После пубертатного периода заболевание может проходить даже без активной терапии. У взрослых, перенесших в детстве витамин-D-резистентный рахит, сохраняется гипофосфатемия, низкорослость, пострахитические деформации конечностей таза, часто обусловливающие кесарево сечение у женщин. Рецидивы возможны в период напряжения минерального обмена (беременность, лактация).
Аутосомно-доминантный гипофосфатемический рахит (HYPOPHOSPHATEMIC RICKETS, AUTOSOMAL DOMINANT; 193100) характеризуется изолированной почечной недостаточностью фосфатов, гипофосфатемией и нетипично нормальным уровнем 1,25-дигидроксивитамина D3 (кальцитриола). Пациенты часто страдают от боли в костях, рахита и абсцесса зубов. В отличие от X-сцепленного доминантного гипофосфатемического рахита, для АД гипофосфатемического рахита характерна неполная пенетрантность, варьирующий возраст начала заболевания (от детского до взрослого) и, в редких случаях, восстановление дефекта истощения фосфатов.
Молеклярно-генетическая причина АД гипофосфатемического рахита – мутации гена FGF23 (fibroblast growth factor 23). Ген картирован в локусе 12p13.32, состоит из 3 экзонов, кодирует белок из семейства факторов роста фиброблатов.
В Центре молекулярной генетики проводится прямая ДНК-диагностика гипофосфатемического рахита методом прямого автоматического секвенирования кодирующих последовательней и прилежащих интронных областей генов FGF23 и PHEX.
Витамин Д-резистентный рахит
Витамин D-резистентный рахит (фосфат-диабет; семейный гипофосфатемический рахит; синдром Олбрайта — Баттлера — Блюмберга) — это наследственное рахитоподобное заболевание, имеющее доминантный сцепленный с Х-хромосомой тип наследования. В структуре рахитоподобных заболеваний занимает наибольший удельный вес. В детской популяции встречается приблизительно 1:25000.
Этиология и патогенез
Первичный биохимический дефект при витамин D-резистентном рахите неизвестен. Можно выделить четыре гипотезы патогенеза, авторы которых связывают развитие витамин Д-резистентного рахита:
- с первичным дефектом кишечника;
- с избирательным дефектом почечных канальцев (первичная тубулопатия);
- с сочетанным поражением почек и кишечника;
- с нарушением метаболизма витамина D.
Однако ни одна из гипотез в отдельности не в состоянии объяснить полностью те клинико-биохимические изменения, которые наблюдаются при этом заболевании. П. В. Новиков (1982) выделяет четыре клинико-биохимических варианта фосфатдиабета, при которых наблюдается либо сочетанный дефект почечных канальцев и кишечника (первый вариант), либо преимущественный дефект почек (второй вариант) или кишечника (третий вариант).
У ряда больных наблюдается гиперчувствительность к витамину D (четвертый вариант). Эти результаты позволили подойти к патогенетически целенаправленной и дифференцированной терапии каждого из вариантов болезни.
Симптомы витамина Д-резистентного рахита у детей
Витамин Д-резистентный рахит может широко варьировать от форм, при которых единственным симптомом является гипофосфатемия, до форм, при которых гипофосфатемия сопровождается тяжелыми костными нарушениями.
- У большинства (в 2/з случаев) детей, больных фосфатдиабетом, изменения скелета выявляются на 2-м году жизни. Однако описаны раннее начало болезни (на первом году жизни) и поздняя манифестация костных изменений — в 7—11-летнем возрасте.
- Изменения скелета касаются главным образом нижних конечностей по типу варусных деформаций значительной степени выраженности.
- Реже варусно-вальгусного типа. Искривления затрагивают кости голеней и бедренные кости, следствием чего является возникновение характерной «утиной» походки.
- Масса тела детей при фосфат-диабете соответствует возрастной норме или даже превышает ее.
- Умственное развитие, как правило, не страдает.
- Среди костной системы в меньшей степени поражаются грудная клетка (с развитием «рахитических четок»), верхние конечности и тазовые кости.
- Однако почти у всех больных обнаруживают утолщения дистальных отделов трубчатых костей предплечий («рахитические браслетки») и деформации черепа.
- Характерная для обычного рахита мышечная гипотония при фосфат-диабете, как правило, отсутствует. У лиц, страдающих фосфат-диабетом, в юношеском возрасте наблюдается низкий рост (148—160 см).
- Преимущественное искривление костей нижних конечностей наряду с их утолщением придает больным псевдоатлетический, приземистый вид.
Диагностика
При рентгенологических исследованиях выявляют два типа костных изменений:
- сходные с теми, что наблюдаются при витамин D-дефицитном рахите в виде системного остеопороза, разрыхленности метаэпифизарных отделов и кортикального уплотнения;
- поражение метафизов уже сформировавшейся кости с развитием остеомаляции.
Характерными биохимическими признаками фосфат-диабета являются выраженная гипофосфатемия (0,5—0,7 ммоль/л), нормальные показатели кальция в крови (2,3—2,6 ммоль/л), повышение активности щелочной фосфатазы крови в 1,5—3 раза по сравнению с нормой. Экскреция фосфатов с мочой у большинства больных повышена: клиренс фосфатов более 0,3 мл/с (при норме 0,1—0,2 мл/с), а кальция либо нормальная, либо снижена. Уровни ПТГ и кальцитонина в крови повышены или нормальные. Показатели содержания витамина D — 25(ОН)Da и l,25(OHhD3 — в сыворотке крови нормальные.
Медикаментозное лечение
При фосфат-диабете используют консервативные и хирургические методы лечения. Консервативная терапия включает использование витамина D или его активных метаболитов. Начальные дозы витамина D2 или Da составляют 20 000 ME в сутки. Повышение дозы проводят постепенно через 2—3 нед под контролем содержания фосфора и кальция в крови и моче. Если достигнуто снижение клиренса фосфатов или его нормализация (0,2—0,3 мл/с) и повышение содержания фосфора в крови, то дальнейшее повышение дозы витамина D проводить не следует.
Максимальные дозы витамина D могут достигать 300 000 ME в сутки. Из метаболитов витамина D показано применение оксидевита в дозе 0,5—1,5 мкг/сут. Можно использовать одновременно оксидевит и витамин Д. Это позволяет уменьшить дозу витамина D и добиться положительного эффекта. В комплекс лечения включают фосфаты: фитин 0,75—1,5 г/сут в зависимости от возраста, неорганические соединения фосфора, например смесь Олбрайта (45 г двузамещенного фосфата натрия + 18,2 г однозамещенного фосфата натрия и 950 мл дистиллированной воды) 80 мл раствора в сутки в 5—6 приемов, глицерофосфат 0,5—1,5 г в сутки. Наряду с этим показано применение витаминов А, Е, группы В.
Наличие тяжелых изменений костной системы служит показанием к хирургическому лечению. Непременным условием для хирургической коррекции костных деформаций является стойкая клинико-лабораторная ремиссия заболевания (в течение не менее 1,5—2 лет).
Витамин д резистентный рахит пенетрантность
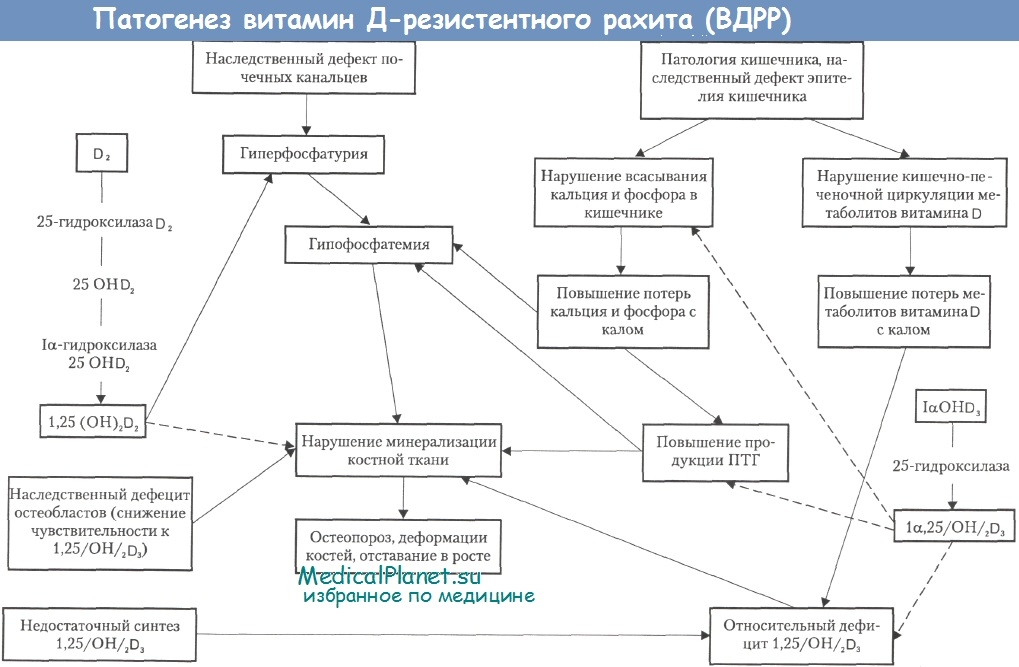
На рисунке представлены три ребенка с одним и тем же заболеванием -витамин Д-резистентный рахит (ВДРР). Дети разного возраста и степень тяжести скелетныхдеформацийу них различна. Эти скелетные изменения появились не сразу, потребовалось время. При рождении дети ничем не отличались от здоровых новорожденных. Скелетные деформации появившиеся и усугубившиеся в процессе постнатальной жизни могли свидетельствовать лишь о том, что ВДРР имеет прогредиентный характер течения.
Если обратиться к литературе, то можно узнать, что в большинстве случаев симптомы болезни обнаруживаются у детей на 2-м году жизни, несмотря (!) на общепринятую профилактику рахита витамином D. Как правило, деформации нижних конечностей по времени совпадают с попыткой ребенка начать самостоятельно ходить. В ряде случаев (но значительно реже) манифестация патологического процесса наступает позже — в возрасте 5-6 лет (поздняя форма).
Основные жалобы ребенка сводятся к болям в ногах при ходьбе. При ранней манифестации заболевания наблюдаются симптомы, свойственные для хорошо известного витамин D-дефицитного рахита: позднее закрытие большого родничка, появление типичных «браслеток», «четок» и мышечной гипотонии. Сомнения в правильности диагноза наступают тогда, когда лечение общепринятыми дозами витамина D, оказывается неэффективным.
По мере роста ребенка не только увеличивается количество костных изменений, но и нарастает степень их тяжести (варусные деформации нижних конечностей — coxa vara, genu vara) и происходит вовлечение в патологический процесс коленных и голеностопных суставов. Походка таких детей становится неуверенной и напоминает «утиную», что и является основной причиной инвалидизации.
Помимо визуально обнаруживаемых изменений, которые сразу же отмечаются врачом, рентгенологические исследования позволяют выявлять наибольшие изменения скелета в зонах энхондрального обезыствления, а также изменения костей черепа, грудной клетки, позвоночника, костей таза и др.. Гистологическое изучение биоптатов костной ткани обнаруживает грубые изменения ее структуры: неравномерная трабекулярность с полостями резорбции, гиперплазия и гипертрофия хрящевых клеток, уменьшение остеоцитов и участки остеопластического и пазушного рассасывания.
Получаемая в процессе специального обследования информация убеждает в том, что эти грубые морфологические изменения не свойственны витамин D-дефицитному рахиту, а свидетельствуют о наличии у ребенка витамин Д-резистентного рахита (ВДРР). Убедительным аргументом в пользу этого диагноза служит и родословная ребенка с доминантным, сцепленным с Х-хромосомой типом наследования.
Известно, что ген витамин Д-резистентного рахита (ВДРР) (HYP-ген) локализован на хромосоме Хр22 и в нем существует несколько мутантных локусов, что и объясняет клинико-генетический полиморфизм этого заболевания.
В диагностике витамин Д-резистентного рахита (ВДРР) главным аргументом является характер метаболических расстройств. Среди патогенетических механизмов возникновения болезни выделяют: первичный дефект реабсорбции фосфатов в почечных канальцах, вторичное нарушение процессов активации витамина D и сочетанный дефект реабсорбции кальция и фосфора в кишечнике. Действительно, при экскреторной урографии у детей с витамин Д-резистентным рахитом (ВДРР) нередко обнаруживают пиелоэктазию на почве обструкции прилоханочных отделов мочеточников и др. аномалии почек.
Согласно современным представлениям HYP-ген регулирует синтез фосфатного транспортного белка в эпителии проксимальных извитых канальцев почек. Молекулярная структура этого белка определяется геном, картированным на хромосоме 5. Нарушения активного транспорта неорганических фосфатов в почечных канальцах создают их постоянный дефицит, что и приводит к формированию рахитоподобных заболеваний скелета. Секреция паратиреоидного гормона (ПТГ) при витамин Д-резистентном рахите (ВДРР) обычно оказывается неизмененной.
(А) — Ребенок 8 лет. Варусные деформации нижних конечностей.
(Б) — Ребенок 9 лет. Деформации скелета.
(В) — Ребенок 10 лет. Грубые деформации скелета.
Изменения костной системы при витамин Д-резистентном рахите (ВДРР):
1. Изменения костей черепа (ассиметрия, теменные и лобные бугры, изменения лицевого черепа).
2. Изменения грудной клетки (деформации, ассиметрия и др.).
3. Деформация костей конечностей:
— верхних,
— нижних,
— плосковальгусные стопы.
4. Изменения позвоночника:
— лордоз,
— кифоз.
5. Изменения костей таза (уменьшение переднезадних размеров, плоский «рахитический» таз и др.).
6. Зубной кариес.
7. Патологические переломы.
8. Рентгенологические изменения костей нижних конечностей:
— варусные деформации,
— вальгусно-саблевидные деформации, в том числе варусно-вальгусного типа,
— нечеткость зон препараторного роста,
— ширина рахитической зоны 1 см и более,
— остеопороз.
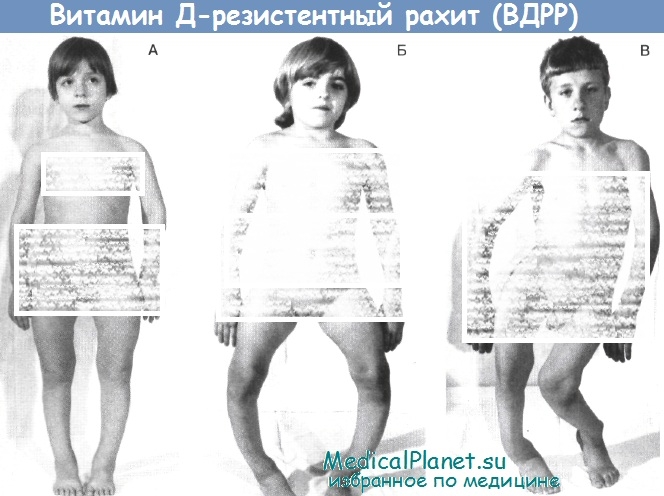
(А) — повышенное скопление радиоиндикатора Тс-99 в эпифизарных отделах костей голеней и бедер.
(Б) -повышенное накопление радиоиндикатора Тс-99 в эпифизах, метафизах и прилегающих отделах диафизов локтевой и лучевой костей.
К характерным биохимическим признакам витамин Д-резистентного рахита (ВДРР) относят (П. В. Новиков):
• гипофосфатемию, когда уровень неорганических фосфатов в сыворотке крови находится в пределах 0,5-0,7 ммоль/л (при норме 1,0-1,6 ммоль/л).
• гиперфосфатурию, при которой экскреция фосфатов с мочой достигает более 20 ммоль/сутки,
• высокий почечнный клиренс фосфатов (30-60 мл/мин/1,73 кв. м при норме 6,0-14 мл/мин./1,73 кв. м),
• нормальный уровень кальция в сыворотке крови,
• повышенная активность щелочной фосфатазы в 1,5-2 раза,
• нормальный уровень паратгормона в крови,
• сниженный плазматический уровень 1,25 дигидроксивитамина D3.
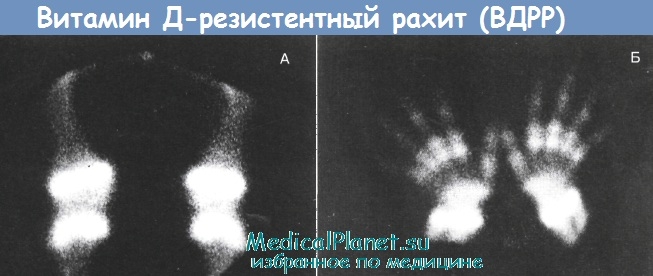
(А) — Рентгенограмма костей голени у ребенка 6 лет. Варусная деформация длинных трубчатых костей, бокаловидные деформации и заостренность концевых отделов, разрыхленность зон препараторного роста, остеопороз.
(Б) — Рентгенограмма костей голени ребенка 9 лет. Варусная деформация, выраженный остеопороз. Патологические поперечные переломы сдвух сторон, грубая трабекулярная перестройка.
(В) — Рентгенограмма костей предплечья и кистей рук. Бокаловидные деформации, заостренность эпиметафизарных отделов, расширение и разрыхленность зон препараторного роста, остеопороз.
Гипотеза механизмов патогенеза при витамин Д-резистентном рахите (ВДРР) представлена насхеме. Степень тяжести скелетных аномалий у детей с ВДРР может объясняться не только прогредиентностью патологического процесса, но и клиническим полиморфизмом этого заболевания. В зависимости от сроков манифестации, клинико-биохимических особенностей, ответной реакции на витамин D выделяют 4 клинико-биохимических варианта болезни:
• Первый вариант витамин Д-резистентного рахита (ВДРР): ранняя манифестация, незначительность костных деформаций, не приводящих к инвалидности, и эффективность лечения витамином D (85000-100000 ME — максимальная доза).
• Второй вариант витамин Д-резистентного рахита (ВДРР): более поздняя манифестация (второй год жизни), выраженные изменения скелета, резистентность к высоким дозам витамина D (150000-200000 ME максимальная доза). При этом варианте обнаруживается преимущественный дефект почечных канальцев (снижение реабсорбции фосфора) и потери фосфатов с мочой.
• Третий вариант ВДРР: поздняя манифестация (после 6 лет), тяжесть скелетных нарушений, выраженная резистентность к витамину D (200 000-300 000 ME- максимальная суточная доза). При этом варианте преимущественно нарушено кишечное всасывание кальция и фосфора.
• Четвертый вариант витамин Д-резистентного рахита (ВДРР) : повышенная чувствительность к витамину D и склонность к гипервитаминозу D (жажда, рвота, гиперкальциурия). Назначение витамина D противопоказано (!).
Таким образом, в качестве доказательств диагноза витамин D-резистентного рахита могут служить следующие аргументы:
• необычно грубые нарушения костей нижних конечностей,
• прогредиентность течения болезни,
• отсутствие эффекта от общепринятых дозировок витамина D для лечения витамин D-дефицитного рахита,
• морфологические и рентгенологические изменения костной ткани,
• патология кишечника и почек,
• доминантный, сцепленный с Х-хромосомой тип наследования,
• характер биохимических расстройств фосфорно-кальциевого обмена,
• эффективность необычно высоких доз витамина D (исключая 4-й вариант).
Витамин-D-резистентный рахит
Рахитоподобные болезни
Рахитоподобные болезни – группа наследственных тубулопатий, клиническая картина которых в ранние сроки заболевания имитирует рахит, но не связана с дефицитом поступающего в организм витамина D; их ведущим синдромом являются аномалии скелета (почечные остеопатии).
Патогенетические механизмы формирования первичных (наследственных) тубулопатий связывают со следующими факторами: генетически детерминированными нарушениями структуры мембранных белков-носителей; энзимопатиями наследственно обусловленной недостаточностью ферментов, обеспечивающих активный мембранный транспорт; изменением чувствительности рецепторов клеток канальцевого эпителия к действию гормонов; изменениями общей структуры цитомембран клеток при дисплазиях, в происхождении которых определенная роль принадлежит наследственным факторам. Вторичные тубулопатий возникают в результате повреждения транспортных систем почечных канальцев как при наследственных, так и при приобретенных болезнях обмена в связи с нарушениями метаболизма за пределами нефрона. Они развиваются также при воспалительных заболеваниях почек, что может обусловить значительные дифференциально-диагностические затруднения.
К рахитоподобным болезням относятся витамин-D-резистентный рахит, витамин-D-зависимый рахит, болезнь де Тони — Дебре — Фанкони и почечный тубулярный ацидоз.
Витамин-D-резистентный рахит (семейный гипофосфатемический рахит, фосфат-диабет) характеризуется доминантным типом наследования, сцепленным с полом, возможен также аутосомно-доминантный тип. Патогенез метаболических расстройств при этом заболевании сложен и в достаточной степени не исследован. Развитие его связывают с первичным нарушением процессов всасывания кальция и фосфора в кишечнике; с первичным дефектом транспорта неорганических фосфатов в почках и повышением чувствительности эпителия канальцев почек к действию паратгормона; с генетически детерминированным сочетанием этих нарушений; с синтезом в организме фосфатурических метаболитов витамина D и недостаточным образованием 25-оксихолекальциферола в печени.
Заболевание проявляется у детей в 1-2 года, но может начаться в более старшем возрасте. Основными проявлениями болезни служат задержка роста и выраженные прогрессирующие деформации скелета, особенно нижних конечностей (по варусному типу, D-образные искривления; рис. 1, а), что сопровождается нарушением походки ребенка («утиная походка»); значительная болезненность костей и мышц, нередко мышечная гипотония; гипофосфатемия и гиперфосфатурия при нормальном содержании кальция в крови (дифференциально-диагностический признак); выявляемые рентгенологически рахитоподобные изменения костей, преимущественно нижних конечностей; сохранности интеллекта у больных детей.
Витамин-D-резистентный рахит отличается выраженным клиническим полиморфизмом. В зависимости от сроков манифестации, клинико-биохимических особенностей, чувствительности и характера ответной реакции на витамин D выделяют 4 клинико-биохимических варианта заболевания. Первый вариант характеризуется ранней (на первом году жизни) манифестацией, незначительной степенью костных деформаций, гипофосфатемией, гиперфосфатурией, повышением уровня паратгормона в крови, хорошей переносимостью витамина D. Второй вариант отличается более поздней (на втором году жизни) манифестацией, выраженными костными изменениями, гипофосфатемией, значительной гиперфосфатурией, резистентностью к высоким дозам витамина D. Третьему варианту присущи поздние сроки проявления заболевания (в 5-6-летнем возрасте), тяжесть поражений скелета, выраженная гипофосфатемия, значительное снижение абсорбции фосфора в кишечнике при нормальной или незначительной гиперфосфатурии; отмечается также нечувствительность к витамину D. Четвертый вариант характеризуется манифестацией на втором году жизни, умеренной степенью костных деформаций, повышенной чувствительностью к витамину D и склонностью к развитию клинико-биохимической картины гипервитаминоза D (рвота, тошнота, жажда, гиперкальциемия, гиперкальциурия и др.) в ответ на небольшие дозы витамина D. Клинический полиморфизм, особенности патогенеза и метаболических расстройств, широкий диапазон ответной реакции на витамин D свидетельствуют о генетической гетерогенности витамин-D-резистентного рахита.
Основными критериями диагностики витамин-D-резистентного рахита служат: клинические проявления — варусный тип и прогрессирующий характер костных деформаций нижних конечностей с отставанием физического развития; доминантный, сцепленный с Х-хромосомой тип наследования патологии; биохимические отклонения в обмене электролитов — низкий уровень фосфора в сыворотке крови, гиперфосфатурия, нормальные показатели общего кальция в крови (2,3-2,75 ммоль/л), повышение активности щелочной фосфатазы крови, повышение уровня паратгормона в крови, снижение абсорбции кальция и фосфора в кишечнике; результаты рентгенологического исследования, при котором выявляют два типа костных изменений: либо изменения эпифизов костей с расширением зон пролиферации хряща, грубоволокнистую структуру кости с признаками остеоидной гиперплазии (полная аналогия с рахитом), либо поражение метафизов уже сформировавшейся кости и проявления остеомаляции. Гистологически в костной ткани обнаруживают нарушение структуры костных каналов и трабекул, пролиферацию хряща, чередование усиленного образования остеоидной ткани с участками остеопороза.
Дифференциальный диагноз витамин-D-резистентного рахита и других Р. б. представлен в таблице. Кроме того, дифференциальный диагноз проводят с рядом заболеваний наследственного и приобретенного характера — болезнью Бланта (при которой основным признаком является нарастающая варусная деформация большеберцовой кости как при отсутствии изменений в других отделах костно-суставной системы, так и метаболических расстройств с системными остеодисплазиями — фиброзной остеодисплазией, остеогенезом несовершенным, мраморной болезнью, Педжета болезнью и др.
Лечение витамин-D-резистентного рахита как и других Р. б., должно быть комплексным. Оно направлено на коррекцию метаболических расстройств, профилактику осложнений и предупреждение инвалидизации ребенка. Показаниями для лекарственной терапии служат: активный процесс в костной ткани (по ренгенологическим данным), повышение активности щелочной фосфатазы крови, повышенная экскреция фосфатов с мочой, подготовка больных к хирургической коррекции. Основными препаратами в терапии витамин-D-резистентного рахита являются витамин и его метаболиты. Начальные дозы витамина D составляют 10 000 — 15 000 ЕД в сутки. Их увеличивают под контролем показателей кальция и фосфора в сыворотке крови и моче, активности щелочной фосфатазы крови, исследования уровня которых должно проводиться каждые 10-14 дней. Максимальные суточные дозы витамина D в зависимости от клинико-биохимических вариантов болезни составляют: при первом варианте 85 000-100 000 ЕД, при втором 150 000-200 000 ЕД, при третьем — 200 000-300 000 ЕД. При четвертом варианте болезни назначение витамина D противопоказано. Из метаболитов витамина D используют оксидевит в суточной дозе 0,25-3 мкг, при применении которого необходим особенно строгий контроль за уровнем кальция в крови (определяется 1 раз в 7-10 дней). В амбулаторных условиях исследуют мочу на содержание кальция путем постановки реакции Сульковича. Противопоказаниями для консервативной терапии витамином D и его метаболитами являются индивидуальная непереносимость препаратов, выраженная гиперкальциурия (более 4 ммоль/сут.), отсутствие активного процесса в костной ткани по данным лабораторных и рентгенологических исследований. В комплекс лечения витамин-D-резистентного рахита включают препараты кальция: глюконат кальция или хлорид кальция по 1,5-2 г в сутки) и фосфора (фитин 1-1,5 г в сутки, глицерофосфат кальция 0,5-1 г в сутки). Для улучшения процессов всасывания кальция и фосфора в кишечнике рекомендуют длительное (5-6 мес.) применение концентрированных цитратных смесей (например, лимонная кислота 24 г, цитрат натрия 48 г и дистиллированная вода 500 мл) по 20-50 мл в сутки. В активной фазе болезни при наличии болей в костях и суставах показан постельный режим продолжительностью до 2 нед. В период клинико-лабораторной ремиссии и наблюдения больных в амбулаторных условиях ограничивают физические нагрузки, занятия физическими упражнениями и лечебный массаж проводят по специальной щадящей программе, назначают соляно-хвойные ванны, осуществляют санаторно-курортное лечение.
Показателями эффективности консервативной терапии являются улучшение общего состояния больных, увеличение темпов роста детей, нормализация или значительное улучшение показателей фосфорно-кальциевого обмена, снижение активности щелочной фосфатазы крови и положительная динамика структурных изменений костной ткани (по данным рентгенологического исследования).
Хирургическое лечение витамин-D-резистентного рахита сводится к корригирующим остеотомиям костей голеней или бедренных костей с последующей иммобилизацией повязкой или дистракционно-компрессионным аппаратом. Обязательным условием для проведения хирургического лечения служит достижение стойкой клинико-биохимической ремиссии в течение не менее 2 лет.
Дата добавления: 2015-07-02 ; Просмотров: 3539 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет