Витамин д его метаболизм
Холекальциферол (витамин D3) образуется в коже. Некоторые соединения (производные стерола) принадлежат к семейству витамина D и выполняют в большей или меньшей степени сходные функции. Витамин D3 (называемый также холекальциферолом) является наиболее важным из них и образуется из 7-дегидрохолестерола (вещества, в норме присутствующего в коже) под влиянием ультрафиолетовых лучей при инсоляции. Следовательно, достаточное по времени пребывание на солнце предупреждает развитие дефицита витамина D.
Дополнительное количество витамина D, поступающее с пищей, идентично холекальциферолу, который образуется в коже, за исключением замены одного или двух атомов в молекуле, что не оказывает влияния на функциональные свойства этого вещества.
Холекальциферол превращается в 25-гидроксихолекальциферол в печени. Первый этап активации холекальциферола заключается в превращении его в 25-гидроксихолекальциферол, которое осуществляется в печени. Этот процесс ограничивается существующей обратной связью, опосредованной 25-гидроксихолекальциферолом, регулирующим таким образом реакцию превращения. Влияние обратной связи чрезвычайно важно по двум причинам.
Во-первых, механизм обратной связи жестко регулирует концентрацию 25-гидроксикальциферола в плазме. Заметим, что поступление витамина D3 может увеличиться во много раз, при этом концентрация 25-гидроксихолекальциферола остается практически неизменной. Высокая надежность контроля механизмом обратной связи предупреждает развитие клинических проявлений гипервитаминоза D, если поступление витамина D3 колеблется в широких пределах.
Во-вторых, регулируемое превращение витамина D3 в 25-гидроксихолекальциферол позволяет депонировать витамин D3 в печени для дальнейшего его использования. 25-гидроксихолекальциферол — конечный продукт реакции превращения, который присутствует в организме всего несколько недель, в то время как витамин D может храниться в печени несколько месяцев.
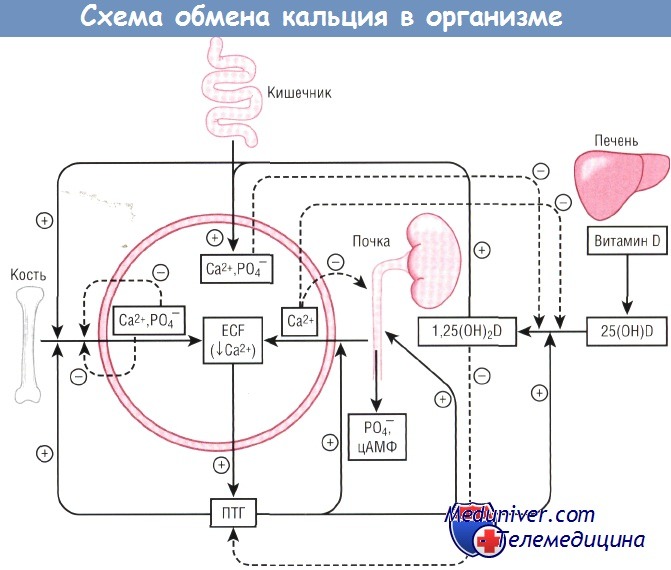
1,25(OH)2D—1,25-дигидроксивитамин D;
25(OH)D—25-гидроксивитамин D;
ECF — эргокальциферол;
ПТГ — паратиреоидный гормон;
цАМФ — циклический аденозинмонофосфат.
Образование 1,25-дигидрохолекальциферола в почках и его регуляция паратгормоном. На рис. 79-6 показано превращение 25-гидроксихолекальциферола в 1,25-дигидроксихолекалъциферол в почках. Это вещество является наиболее активной формой витамина D. Его предшественники обладают 1/1000 активности этой формы, поэтому при отсутствии почек витамин D утрачивает все свои влияния практически полностью.
Превращение 25-гидроксихолекальциферола в 1,25-дигидроксихолекальциферол требует участия паратгормона. При отсутствии паратгормона 1,25-дигидроксихолекальциферол практически не образуется. Следовательно, функциональные эффекты витамина D детерминированы активным влиянием паратгормона.
Концентрация ионов кальция управляет образованием 1,25-дигидроксихолекальциферола. На рисунке показано, что концентрация 1,25-дигидроксихолекальциферола обратно пропорциональна концентрации кальция в плазме. Это объясняется двумя причинами. Во-первых, сами ионы кальция оказывают небольшое влияние на предотвращение превращения 25-гидроксихолекальциферола в 1,25-дигидроксихолекальциферол. Во-вторых, что более важно, секреция паратгормона резко подавляется, если концентрация ионов кальция в плазме повышается до 9-10 мг/дл, поэтому, если концентрация кальция ниже этого уровня, паратгормон обеспечивает превращение в почках 25-гидроксихолекальциферола в 1,25-дигидроксихолекальциферол.
При более высокой концентрации кальция, когда секреция паратгормона подавляется, 25-гидроксихолекальциферол превращается в другое соединение — 24,25-дигидроксихолекальциферол, который почти не обладает свойствами витамина D. Если концентрация кальция в плазме слишком высока, образование 1,25-дигидроксихолекальциферола резко снижается. Его отсутствие приводит к снижению всасывания кальция из желудочно-кишечного тракта, почек и костей, что нормализует концентрацию кальция в плазме.
Метаболизм витамина Д и его роль в организме – чего должны опасаться 90 % россиян?
Примерно 90 % россиян в зимнее время страдают от нехватки жизненно важного гормона. Ранее его считали витамином, но, изучив метаболизм витамина Д более глубоко, ученые пришли к выводу, что по своей природе он более близок к гормонам. Оказывается, он участвует не только в обмене кальция, но и в размножении и дифференцировке клеток, регулирует иммуногенез.
Как происходит метаболизм витамина Д?
Существуют два пути появления этого витамина в организме:
— с пищей (D3: рыбий жир, печень, желтки, жирные молочные продукты, D2: дрожжи, грибы);
— биосинтез в коже под воздействием ультрафиолета из гидрированного холестерола.
В первом случае он всасывается в кишечнике, но для этого необходимо присутствие в пище жиров. Во втором нужна либо мощная ультрафиолетовая лампа, либо солнечный свет. И второй путь предпочтительнее, потому что образуется более активная форма витамина Д – D3.
Ни эргокальциферол (Д2), ни холекальциферол (Д3) сами по себе не активны, роль витамина Д в чистом виде невелика – биологические функции выполняют его гидроксилированные формы. Именно к ним чувствительны рецепторы кальциферолов, открытые не так давно. Метаболизм витамина Д (гидроксилирование) протекает в печени, почках и частично в костной ткани и плаценте – там есть необходимые для этого процесса ферменты.
Биологическая роль витамина Д
Роль витамина Д в человеческом организме изучается давно. Это:
- увеличение всасывания ионов кальция в кишечнике;
- предотвращение потерь кальция и фосфора с мочой путем усиления их повторного всасывания в почечных канальцах;
- подавление секреции паратгормона, угнетающего синтез костной ткани и стимулирующего её разрушение;
- резорбция (разрушение) костной ткани и её остеогенез (образование) – в этих процессах участвуют разные метаболиты кальциферола;
- участие в делении клеток;
- участие в дифференцировке клеток, то есть приобретении ими особых функций при развитии из одинаковых клеток-прародителей (например, из мезенхимальных клеток могут развиться хондроциты, остеобласты, адипоциты, фибробласты и миобласты);
- регуляция иммунитета, поскольку кальциферол влияет на дифференцировку кровяных и иммунных клеток;
- стимуляция выработки антимикробных пептидов;
- метаболизм витамина Д влияет на регуляцию выработки цитокинов, а значит – ограничение воспалительных процессов.
Чем чреват дефицит витамина Д?
Учитывая роль витамина Д, стоит отметить, что его недостаток крайне вреден для организма и становится фактором развития остеопороза, вирусных инфекций, гипертонии, атеросклероза, аутоиммунных заболеваний, диабета, склероза, шизофрении, гипотиреоза, рассеянного склероза и ряда опухолей. Как мы уже сказали выше, в зимнее время это грозит 90 % россиян.
Гиповитаминоз (хотя правильнее назвать это гормональной недостаточностью) развивается при недостаточном поступлении с пищей и малом количестве солнца. С молоком и яйцами поступает очень небольшое количество витамина Д, а свежую морскую рыбу едят в основном на побережье, а не в континентальной части страны. Так что прием добавок с витамином Д жизненно необходим.
Но они окажутся бесполезны, если в пище слишком мало жиров для всасывания кальфицерола или нарушены функции печени и почек. Как мы помним, именно там происходит превращение его в активные формы. Именно поэтому если вы принимаете D3, но продолжаете часто болеть, а ногти и зубы теряют прочность, нужны и другие биологически активные добавки:
- растительные горечи для стимуляции печени (содержатся в девясиле, корне одуванчика, календуле – травах, которые выпускаются сегодня в таблетированной форме);
- полезные жиры для функционирования все того же органа (омега-3 жирные кислоты из семян льна);
- тритерпены и флавоноиды для снятия воспалений в почках и улучшения их функции (календула, одуванчик, зверобой).
Принимая добавки витамина Д, а также при необходимости поддерживая печень и почки, вы сможете избавиться от симптомов гиповитаминоза Д.
ВИТАМИН Д: О ДОЗИРОВКАХ, ОСОБЕННОСТЯХ МЕТАБОЛИЗМА И ПОБОЧНЫХ ЭФФЕКТАХ «СОЛНЕЧНОГО ВИТАМИНА»
ОБРАЗОВАНИЕ ВИТАМИНА Д, ЕГО МЕТАБОЛИЗМ И ОСНОВНЫЕ БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ
ФАКТОРЫ, ВЛИЯЮЩИЕ НА УСВАИВАНИЕ ВИТАМИНА Д
Основными факторами, оказывающими существенное влияние на показатели насыщенности организма человека витамином D, являются интенсивность ультрафиолетового облучения кожных покровов и уровень его потребления с пищевыми продуктами или в виде добавок и лекарственных препаратов.
Высокий риск развития дефицита витамина Д имеют пациенты с тёмной кожей, ожирением, печёной недостаточностью 2-4 степени, синдромом мальабсорбции, гранулёматозными заболеваниями, хронической болезнью почек, пожилые пациенты.
Не меньшее значение имеют и генетические факторы. Вклад генотипа в колебания сывороточных показателей 25(OH)D составляет от 23-43% до 77-80%. В качестве основных генов кандидатов, мутации в которых влияют на концентрации 25(OH)D, определены гены GC (DBP), CYP24A1, CYP2R1, CYP27B1, VDR, NADSYN1/DHCR7.
ОСНОВНЫЕ ФОРМЫ ВИТАМИНА Д
Существуют нативные (холекальциферол Д3 и эргокальциферол Д2) и активные (альфакальцидиол и кальцитриол) метаболиты витамина D. Нативным формам необходимо пройти две реакции гидроксилирования (в печени и почках) для образования D-гормона. В организме эти препараты накапливаются в неактивной форме и превращаются в 1,25 (ОН) D по мере необходимости. Именно с этим связаны их низкая токсичность, широкий терапевтический диапазон и возможность применения в высоких дозах.
Механизм действия препаратов обеих групп аналогичен таковому природного витамина D и заключается в связывании с рецепторами витамина Д в органах–мишенях и обусловленными их активацией фармакологическими эффектами (усиление всасывания кальция в кишечнике и др.). Различия в действии отдельных препаратов носят в основном количественный характер и определяются особенностями их фармакокинетики и метаболизма. Как указывалось выше, препараты нативных витаминов D2 и D3 подвергаются в печени 25–гидроксилированию с последующим превращением в почках в активные метаболиты, оказывающие соответствующие фармакологические эффекты. В этой связи и в соответствии с указанными выше причинами процессы метаболизации этих препаратов, как правило, снижаются у лиц пожилого возраста, при разных типах и формах первичного и вторичного остеопороза(ОП), у пациентов, страдающих заболеваниями ЖКТ, печени, поджелудочной железы и почек (ХПН), а также на фоне приема, например, противосудорожных и других препаратов, усиливающих метаболизм 25(ОН)D до неактивных производных. Кроме того, дозы витаминов D2 и D3 и их аналогов в лекарственных формах способны в физиологических условиях усиливать абсорбцию кальция в кишечнике, но не позволяют преодолеть его мальабсорбцию при разных формах ОП, вызывающих подавление секреции ПТГ, и не оказывают отчетливого положительного влияния на костную ткань
Этих особенностей лишены препараты, содержащие активные метаболиты витамина D3 : 1a,25(ОН)2D3 (МНН – кальцитриол; химически идентичен собственно D–гормону) и его синтетическое 1a–производное – 1a(ОН)D3 (МНН – альфакальцидол). Оба препарата сходны по спектру фармакологических свойств и механизму действия, но различаются по фармакокинетическим параметрам, переносимости и некоторым другим характеристикам
НОРМЫ ВИТАМИНА Д. РЕКОМЕНДАЦИИ РОССИЙСКОЙ АССОЦИАЦИИ ЭНДОКРИНОЛОГОВ
Дефицит витамина D определяется как концентрация 25 (ОН)D
НОРМЫ ВИТАМИНА Д. РЕКОМЕНДАЦИИ MAYO CLINIC
КАК ОПРЕДЕЛИТЬ ИНДИВИДУАЛЬНУЮ НОРМУ?
- Сдать анализ на 25(ОН)витамин Д.
2.Определиться с целевым значением.
3.Воспользоваться таблицей ниже. Принимать рассчитанную дозировку 3 месяца, пересдать анализ.
4. При достижении целевых значений переходить на RDA(recomended daily allowance)
РЕКОМЕНДУЕМЫЕ УРОВНИ ЕЖЕДНЕВНОГО УПОТРЕБЛЕНИЯ(RECOMMENDED DAILY ALLOWANCE) И ДОПУСТИМЫЕ ВЕРХНИЕ УРОВНИ УПОТРЕБЛЕНИЯ ВИТАМИНА D(TOLERABLE UPPER INTAKE LEVEL)
DRI(Daily Recommended Intake) — это общий термин для набора контрольных значений, используемых для планирования и оценки потребления питательных веществ здоровыми людьми. Эти значения, которые различаются по возрасту и полу, включают в себя:
RDA (Recommended Dietary Allowance)Рекомендуемое употребление с продуктами питания: среднесуточный уровень потребления, достаточный для удовлетворения потребности в питательных веществах почти у всех (97–98%) здоровых людей.
AI(Adequate Intake)Адекватное потребление : Предполагается, что потребление на этом уровне обеспечивает адекватность питания; устанавливается, когда доказательств недостаточно для разработки RDA.
EAR(Estimated Average Requirement)Расчетная средняя потребность: среднесуточный уровень потребления, рассчитанный для удовлетворения потребностей 50% здоровых людей;.
UL(Tolerable Upper Intake Level )Допустимый верхний уровень потребления : максимальная суточная доза, которая вряд ли вызовет неблагоприятные последствия для здоровья.
Долгосрочное потребление выше UL увеличивает риск неблагоприятных последствий для здоровья
Чрезмерное пребывание на солнце не приводит к токсичности витамина D, поскольку считается, что устойчивое тепло на коже приводит к фотодеградации превитамина D3 и витамина D3 по мере его образования. Кроме того, термическая активация превитамина D3 в коже приводит к появлению различных форм не витамина D, которые ограничивают образование самого витамина D3. Некоторое количество витамина D3 также превращается в неактивные формы. Потребление витамина D из пищи, которая достаточно высока, чтобы вызвать токсичность, очень маловероятно. Токсичность гораздо чаще возникает из-за большого потребления пищевых добавок, содержащих витамин D.
Токсичность витамина D может вызывать неспецифические симптомы, такие как: потеря аппетита, тошнота и рвота, сопровождаемые жаждой, чрезмерным мочевыделением, слабостью, нервозностью, повышением артериального давления и аритмией. В перспективе это может также поднять уровень кальция в крови, что приводит к кальцификации сосудов и тканей с последующим повреждением сердца, кровеносных сосудов и почек . Сывороточная концентрация 25 (OH) D в течение продолжительного периода> 500 нмоль / л (> 200 нг / мл) считается потенциально токсичной.
На н.в. предлагается пороговое значение токсичности для витамина D от 10000 до 40000 МЕ / день и для уровней 25 (OH) D в сыворотке крови 500–600 нмоль / л (200–240 нг / мл). В то время как симптомы токсичности маловероятны при ежедневном потреблении ниже 10000 МЕ / день, Food and Nutrition Board указал на новые научные данные из национальных обследований, обсервационных исследований и клинических испытаний, предполагающих, что даже более низкие уровни потребления витамина D и уровня 25 (OH) D в сыворотке могут иметь неблагоприятные последствия.
ВЗАИМОДЕЙСТВИЕ ВИТАМИНА Д С ЛЕКАРСТВАМИ
Добавки с витамином D могут взаимодействовать с несколькими видами лекарств. Несколько примеров приведены ниже. Лица, принимающие эти лекарства на регулярной основе, должны обсудить потребление витамина D со своим лечащим врачом.
Кортикостероидные препараты, такие как преднизолон, могут снижать абсорбцию кальция и нарушать метаболизм витамина D. Эти эффекты могут также способствовать потере костной массы и развитию остеопороза, связанного с их длительным использованием.
Как препарат для похудения, орлистат (торговые марки Xenical® и alliTM), так и препарат, снижающий холестерин, холестирамин (торговые марки Questran®, LoCholest® и Prevalite®) могут снижать абсорбцию витамина D и других жирорастворимых витаминов .
Как фенобарбитал, так и фенитоин (торговая марка Dilantin®) используются для предотвращения и контроля эпилептических припадков, повышения метаболизма витамина D в печени до неактивных соединений и снижения абсорбции кальция.
СПИСОК ПРЕПАРАТОВ, ВЗАИМОДЕЙСТВУЮЩИХ С ВИТАМИНОМ Д3
Витамин д его метаболизм
С.В. МАЛЬЦЕВ, Г.Ш. МАНСУРОВА
Казанская государственная медицинская академия, 420012, г. Казань, ул. Бутлерова, д. 36
Мальцев Станислав Викторович — доктор медицинских наук, профессор, заведующий кафедрой педиатрии с курсом поликлинической педиатрии, тел. (843) 236-20-84, e-mail: [email protected]
Мансурова Гузель Шамилевна — кандидат медицинских наук, доцент кафедры педиатрии с курсом поликлинической педиатрии, тел. +7-917-390-79-20, e-mail: [email protected]
В статье представлен обзор литературы по метаболизму витамина D и его основных функциях. Изложены трансформация в организме витаминов D2 и D3, роль витамин D-связывающего белка, рецепторов витамина D, генные и негенные эффекты кальцитриола, обусловливающих его многообразные функции. Показана роль желчных и жирных кислот в процессах всасывания витамина D и связь витамина D с фосфатно-кальциевым метаболизмом.
Ключевые слова: витамин D, 25(ОН)D, кальцитриол, 1,25(OH)2D, витамин-D-связывающий белок, рецепторы витамина D.
S.V. MALTSEV, G.Sh. MANSUROVA
Kazan State Medical Academy, 36 Butlerov St., Kazan, Russian Federation, 420012
Metabolism of vitamin D and means of its main functions’ implementation
Maltsev S.V. — D. Med. Sc., Professor, Head of the Department of Pediatrics with a course in Polyclinic Pediatrics, tel. (843) 236-20-84, e-mail: [email protected]
Mansurova G.Sh. — Cand. Med. Sc., Associate Professor of the Department of Pediatrics with a course in Polyclinic Pediatrics, tel. +7-917-390-79-20, e-mail: [email protected]
The article presents a review of literature on the issue of vitamin D metabolism and its functions. The authors discuss the vitamins D2 and D3 transformations in the organism, the role of vitamin D-binding protein and the vitamin D receptors, the genetic and non-genetic effects of calcitriol which determine its various functions. The role of bile and fatty acids in the process of vitamin D absorption is shown, as well as the connection of vitamin D with phosphate-calcium metabolism.
Key words: vitamin D, 25(ОН)D, calcitriol, 1,25(OH)2D, vitamin-D-binding protein, vitamin D receptors.
Изучение метаболизма витамина D продолжается уже более 100 лет, со времени открытия McCollum с соавт. в 1913 г. некоего «жирорастворимого фактора роста», который они обнаружили в рыбьем жире. Воздействие данного фактора при лечении рахита оказалось настолько эффективным, что сделало рыбий жир почти панацеей, а главное дало мощный толчок научным исследованиям витамина D во всем мире. В 1928 г. А. Виндаус завершил цикл работ по выделению витамина D и установлению структуры растительных стеринов или стеролов, за что был удостоен Нобелевской премии по химии [1, 2]. Отечественные ученые в ХХ веке, в том числе и представители Казанской медицинской школы, внесли большой вклад в изучение метаболизма и роли витамина D при профилактике и лечении рахита — работы Н.Ф. Филатова, А.А. Киселя, Г.Н. Сперанского, Е.М. Лепского, К.А. Святкиной и др.
Наиболее значимыми событиями 60–80-х годов XX века следует считать открытие и изучение действия метаболитов витамина D, а также оценка обеспеченности различных групп населения витамином D. Так, в 1966-1967 гг. было установлено наличие полярных метаболитов витамина D3 в организме, которые обладали более высокой биологической активностью, чем исходный витамин. В 1973 г. синтезирован высокоактивный аналог витамина D — альфакальцидол. Под руководством Holick M. в 1997 г. выделен активный метаболит витамина D3 — 1,25-дигидроксивитамин D3.
Витамин D образуется в коже под влиянием УФО или поступает с пищей, затем происходит цепь метаболических процессов с образованием активных метаболитов витамина D, которые совместно с паратиреоидным гормоном и кальцитонином обеспечивают регуляцию обмена кальция и фосфатов — так называемое классическое действие витамина D. Уменьшают синтез витамина D жизнь в высоких широтах (ближе к полярным регионам), особенно в зимние месяцы, высокий уровень загрязнения атмосферы, плотное покрытие земли облаками, закрытая одеждой кожа, использование солнцезащитного крема и смуглый тип кожи.
В настоящее время наблюдается значительная эволюция знаний о витамине D, уточнены метаболические пути и новые рецепторно опосредованные механизмы иммунологического действия (антиканцерогенное, иммуномодулирующее, противовоспалительное и др.). Благодаря исследованиям многих научных групп (De Luca, M. Holick, М. Pettifor и др.) за последние десятилетия существенно изменились представления о роли витамина D в организме 4. Так, показано, что активные метаболиты витамина D оказывают воздействие на многочисленные физиологические процессы [3, 6-8]. Установлено, что низкий уровень обеспеченности витамином D высоко ассоциирован с риском развития инфекционных (острые респираторные вирусные инфекции, туберкулез), сердечно-сосудистых (артериальная гипертензия, сердечная недостаточность), хронических воспалительных (болезнь Крона, целиакия), аллергических (бронхиальная астма), аутоиммунных (рассеянный склероз, сахарный диабет 1-го типа, псориаз) и различных неопластических заболеваний (рак молочной железы, рак прямой кишки, рак простаты) 12. Таким образом, признано, что витамин D пересек границы метаболизма кальция и фосфатов и стал фактором обеспечения важнейших физиологических функций
Достигнуты значительные успехи в изучении метаболизма витамина D в организме, механизмов и путей реализации его биологических эффектов. К группе витамина D относится шесть стеринов (витамины D1, D2, D3, D4, D5 и D6). Ключевую роль в организме человека играют два из них: витамин D2 — эргокальциферол и витамин D3 — холекальциферол. Это близкие по химической структуре иимеющие сходные этапы метаболизма соединения. Они представляют собой кристаллы без цвета и запаха, устойчивые к воздействию высоких температур, нерастворимые в воде и хорошо растворимые в жирах и органических соединениях. В виде предшественников могут поступать в организм человека как жирорастворимый компонент растительной (эргостерол) или животной (7-дигидрохолестерол) пищи и подвергаться всасыванию вместе с жирами в тонкой кишке.
Витамин D2 — эргокальциферол (рис. 1) образуется в клетках растений из эргостерола. Основные источники эргокальциферола — рыба, молоко, а также хлеб и грибы. Витамин D2, поступающий в организм с пищей, всасывается в тонком кишечнике, обязательно в присутствии желчи, далее включается в состав хиломикронов и транспортируется лимфатической системой в венозный кровоток, проходя затем аналогичные с холекальциферолом этапы метаболизма. Для его нормального всасывания необходимо присутствие в пище достаточного количества жира. Нарушение секреции желчи при заболеваниях печени и желчевыводящих путей существенно затрудняет всасывание витамина в кишечнике [14]. Эргокальциферол доступен также в форме различных лекарственных препаратов, однако проявляет крайне малую витаминную активность, в связи с чем практически не применяется и с 2012 г. эргокальциферол исключен из списка жизненно необходимых и важнейших лекарственных препаратов.
Эргокальциферол

Холекальциферол
Витамин D3 — холекальциферол (рис. 2) образуется в мальпигиевом и базальном слое эпидермиса кожи из 7-дегидрохолестерола (превитамин D) в результате неферментативной, зависимой от ультрафиолетового света, с длиной волны 290-315 нм, реакции фотолиза. Активность процесса находится в прямой зависимости от интенсивности облучения и в обратной — от степени пигментации кожи. В эпидермисе холекальциферол связывается с витамин D-связывающим белком и 70% его из кровотока поступает в печень, а другая часть поступает в жировые клетки, где формируется депо витамина D. Показано, что при воздействии солнечных лучей на кожу человека в одной эритемной дозе, содержание витамина D3 в крови увеличивается так же, как после приема внутрь 10 000 МЕ витамина D3 [15]. Однако развитие гипервитаминоза D при длительной инсоляции не происходит благодаря блокированию поступления избытка витамина D из кожи в кровоток и трансформации его в неактивные соединения. С возрастом содержание7-дегидрохолестерола в эпидермисе снижается, соответственно, синтез витамина D3 уменьшается и после 65 лет его уровень уменьшается более чем в 4 раза [1, 2].
Несмотря на то, что форма D3 обладает большей метаболической активностью, а потому более значима для человека, все же корректнее говорить об обмене витамина D в целом. Сам по себе витамин D биологически неактивен, реализация его биологических эффектов возможна лишь после метаболических преобразований в печени до 25-гидроксивитамина D (25(OH)D, или кальцидиола) и в почках до 1,25-дигидроксивитамина D (1,25(OH)2D, или кальцитриола), который является конечным и самым активным метаболитом витамина D, а по специфике своего действия приравнивается к гормонам (D-гормон). Это стероидный гормон с эндокринным, паракринными и аутокринным эффектом.
Таким образом, основные процессы биотрансформации витамина D происходят в коже, печени и почках (рис. 3).
Метаболизм витамина D
На первом этапе метаболизма витамин D комплексируется с витамин-D-связывающим белком (VDBP) и альбумином и транспортируются в печень. Далее в купферовских клетках печени под воздействием мембранного фермента семейства цитохрома P450 25-гидроксилазы (CYP3A4) холекальциферол и эргокальциферол путем гидроксилирования превращаются в первый активный метаболит — 25(ОН)D (25-гидроксивитамин D-кальцидиол). В исследованиях последних лет по идентификации ферментов, осуществляющих реакции гидроксилирования витамина D3 до 25(OH)D3, показано, что в этой реакции задействованы также изоферменты цитохрома P-450: CYP2C9 и CYP2D6 [16]. 25(ОН)D — является основным циркулирующим метаболитом витамина D, период его жизни составляет около 3 недель. Концентрация этого метаболита у здоровых детей находится в пределах 15-40 нг/мл, повышаясь летом, благодаря инсоляции до 25-40 нг/мли снижаясь зимой и ранней весной до 15-25 нг/мл. Уменьшение этого метаболита до 10 нг/мл свидетельствует о маргинальной обеспеченности организма витамином D и позволяет говорить о D-дефиците. Уровень 5 нг/мл и ниже соответствует состоянию D-авитаминоза. Известны заболевания, при которых нарушается образование 25(ОН)D — это болезни печени, генетически детерминированное снижение или блок активности α-гидроксилазы при назначении лекарственных препаратов (люминал и другие противосудорожные препараты, глюкокортикоиды), конкурирующих за связь с конвертирующим ферментом [17, 18]. Таким образом, могут возникать условия для эндогенного дефицита витамина D даже при его достаточном экзогенном поступлении в организм. Всасывание витамина D существенно зависит от присутствия других нутриентов [19].
25-гидроксихолекальциферол считается наиболее точным индикатором уровня витамина D. Это связано с тем, что 25(OH)D характеризуется длительным периодом полувыведения (около 3 недель). Уровень 25(OH)D отражает скорость накопления как эндогенного, так и экзогенного витамина D. Кроме того, синтез 25(OH)D в печени преимущественно регулируется субстратом, то есть неактивной формой витамина D, и в меньшей степени подвержен гуморальным воздействиям. Преобладающее количество метаболитов витамина D циркулирует в крови в связанном с VDBP состоянии и лишь очень небольшая его часть (0,02-0,05% 25(OH)D и 0,2-0,6% 1,25(OH)2D) остается свободной. Концентрация не связанных с белком метаболитов витамина D поддерживается на достаточно стабильном уровне даже при заболеваниях печени и снижении продукции витамин D-связывающего белка и поэтому не является достоверным индикатором содержания витамина D в организме. В этой связи уровень витамин-D-связывающего белка в сыворотке крови может являться маркером физиологических и патологических изменений во время беременности, при заболеваниях печени, нефротическом синдроме и т.д.
Приблизительно 90-95% 25(ОН)D тесно связаны со специфическим α-глобулином — витамин-D-связывающим белком (VDBP), который в свою очередь связан с сывороточным альбумином. У человека выделены 3 основных циркулирующих варианта VDBP (Gc1F, С2, и Gc1S), которые отличаются их сродством к 25(OH)D. Частота их полиморфизма отличается у лиц разных народностей и этносов. Так, вариант Gc1F чаще встречается у лиц с африканской родословной. У черных американцев установлено преобладание высокоаффинного Gc1F фенотипа с высоким сродством, причем у гомозигот уровень VDBP составлял лишь половину его концентрации у белых, у которых преобладал вариант Gc1S. Чернокожие имеют более низкие уровни 25(ОН)D, им чаще ставят диагноз дефицит витамина D, но по сравнению с белыми они имеют более высокую минеральную плотность костной ткани и более низкий риск переломов [20, 21].
На втором этапе метаболизма при помощи транспортных белков (VDBP) 25(OH)D3 переносится в почки (рис. 4). Комплекс 25(OH)D3/VDBP взаимодействует с эндоцитозными рецепторами клеток проксимальных канальцев — мегалином и кубилином, которые реабсорбируют 25(OH)D3 из клубочкового фильтрата. На этом этапе метаболизма 25(OH)D3 гидроксилируется в почках при помощи митохондриального фермента семейства цитохрома P450 1a-гидроксилазы (CYP27B1) и 24-гидроксилазы до биологически высокоактивного метаболита кальцитриола (1,25(OH)2D и 24,25(ОН)2D).
По современным представлениям, 1,25(ОН)2D — это гормон, по своей активности в 10-100 раз (по разным данным) превышающий активность 25(ОН)D. Показано, что основная доля 1,25(OH)2D в организме человека синтезируется в проксимальных канальцах почек, но некоторая часть синтезируется в разных типах клеток, которые экспрессируют CYP27B1 [22]. Имеются многочисленные доказательства того, что виммунных, эпителиальных клетках организма, костной ткани, эндотелии сосудов, паратиреоидных железах, слизистой оболочке кишечника 25(ОН)D3 конвертируется в 1,25(ОН)2D3 с помощью изофермента цитохрома Р-450 CYP27A1 и митохондриального энзима CYP27В1 [23]. Предполагается, что ренальная продукция 1,25(ОН)2D3 направлена на осуществление «классических» функций витамина D, а экстраренальная — на реализацию других биологических эффектов, на сегодняшний день являющихся предметом многочисленных исследований 26. Считается, что дополнительный путь, но уже локальной коррекции метаболизма этого витамина, реализуется через способность многих клеток и тканей осуществлять паракринную секрецию кальцитриола за счет активности 25(ОН)D-1α-гидролазы [26].
Таким образом, 25(ОН)D является транспортной формой витамина D, а 1,25(ОН)2D — его гормональной формой, механизм действия которой аналогичен классическому действию стероидных гормонов. Данные о физиологической роли 24,25(ОН)2D противоречивы, известно, что он обладает некоторыми свойствами гормона. Считается, что его образование — главный способ катаболизма и экскреции производных витамина D в организме, т.е. это путь детоксикации избыточного количества витамина.
Молекулярные механизмы воздействия витамина D
Скорость образования 1,25(ОН)2D зависит от сывороточной концентрации кальция, фосфата, паратиреоидного гормона (ПТГ). Последний непосредственно стимулирует синтез 1,25(ОН)2D, активируя 1-α-гидроксилазу, CYP27В1 в клетках проксимальных почечных канальцев. На концентрацию ПТГ в свою очередь по механизму обратной связи влияет как уровень самого активного метаболита витамина D3, так и концентрация ионизированного кальция в плазме крови [27].
Проведенные ранее исследования показали, что 1,25(OH)2D3 является стероидным гормоном и его конечная точка приложения непосредственно связана с генетически детерминированными свойствами рецептора витамина D. Кальцитриол, подобно стероидным гормонам, оказывает свое биологическое действие после связывания со специфическими рецепторами-мишенями.
На сегодняшний день доказано, что мишенями активных метаболитов витамина D3 являются рецепторы витамина D3 (VDR — vitamin D receptor), которые присутствуют более чем в 38 органах и тканях организма и обеспечивают его плейотропный эффект [28, 29]. В этих тканях-мишенях VDR функционируют как в клеточных ядрах — в качестве фактора, влияющего на транскрипцию около 3% всего человеческого генома, так и в плазматических мембранах в качестве модулятора экспрессии генов и активности целого ряда важнейших физико-химических и биохимических процессов [30]. Пониженный уровень кальцитриола ведет к снижению активации VDR, расположенных практически во всех тканях и органах, включая кишечник, почки, кости, иммунные клетки, кожу, сердце и мозг, что вызывает многообразные функциональные и морфологические нарушения. Напротив, активация VDR метаболитами витамина D, в частности при хронических заболеваниях почек, способна предотвратить или значительно уменьшить многие негативные последствия ХБП и снизить скорость потери почечной паренхимы.
Витамин D-рецепторы относятся к так называемому суперсемейству рецепторов стероидно-ретиноидно-тиреоидных гормонов. Эти рецепторы локализуются в клеточном ядре и способны избирательно связываться с небольшими по размерам липофильными молекулами-лигандами, проникающими через клеточную мембрану с последующей диффузией в ядро. Образуются димерные молекулы, связывающиеся со специфичным реагирующим элементом ядерной ДНК, за счет чего происходит модуляция транскрипции генов в клетках-мишенях, что вызывает изменение синтеза белковых молекул, осуществляющих в свою очередь реализацию соответствующих физиологических и биохимических реакций [14].
Таким образом, исследования последних лет сформировали представление о витамине D как о D-гормоне, обеспечивающем эффект как на генном, так и негенном уровне 31. На генном уровне его активные метаболиты связываютсясо специфическими рецепторными белками. Гормон-рецепторный комплекс D3(VDR) имеет свой специфичный ДНК связывающий домен. При взаимодействии D3(VDR) комплекса с хроматином регуляторных областей ДНК образуется соединение VDR-ДНК, в результате чего избирательно стимулируется транскрипция ДНК. Этот процесс в свою очередь приводит к биосинтезу новых молекул мРНК и трансляции соответствующих белков, которые участвуют в физиологическом ответе. Например, активируется синтез одних белков (кальций-связывающий белок, остеокальцин, остеопонтин, кальбидин, орнитинкарбоксилаза, 24-гидроксилаза) или угнетается образование других (провоспалительныеинтерлейкины и др.) 35. Показано, что на уровне транскрипции гена кальцитриол имеет прямой ингибирующий эффект на паращитовидные железы через супрессию мРНК ПТГ. Кальцитриол влияет на секрецию ПТГ также непрямым путем, повышая уровень Са сыворотки за счет усиленной адсорбции в кишечнике. Рецепторы к витамину D обнаружены не только в тонкой кишке и костях, но и в почках, поджелудочной железе, скелетных мышцах, гладких мышцах сосудов, клетках костного мозга, самой кости, а также в лимфоцитах, моноцитах, макрофагах. На протяжении последних десятилетий активно изучается роль гена, кодирующего рецептор VDR. Установлено, что VDR является медиатором действия 1,25(OH)2D3 путем модуляции транскрипции генов-мишеней и, на сегодняшний день, позиционирован как один из генов-кандидатов генетического контроля поддержания достаточной костной массы [36]. В работах последних лет продемонстрировано наличие ассоциации аллелей VDR с процессом ремоделирования костей и с минеральной плотностью костной ткани [37, 38].
Негенные механизмы воздействия витамина D активно изучаются, показана их важная роль в паракринном и аутокринном действии 1,25(OH)2D3. Рецепторы к кальцитриолу обнаружены в большинстве тканей организма и обладают способностью синтезировать его благодаря наличию собственной 25ОНD-1α-гидроксилазы. Таким образом, дополнительный путь, но уже локальной коррекции метаболизма этого витамина, реализуется через способность многих клеток и тканей осуществлять паракринную секрецию 1,25(OH)2D3 кальцитриола за счет активности 25ОНD-1a-гидролазы.
Почечная продукция 1,25(OH)2D происходит в ответ на снижение уровня ионов Са 2+ в сыворотке крови. Снижение содержания ионов Са 2+ в сыворотке крови стимулирует и продукцию паратгормона паращитовидными железами. Паратгормон индуцирует экспрессию CYP27B1 в клетках первичных почечных канальцев. Активность продукции кальцитриола в основном зависит от уровня содержания ионов кальция и фосфатов, фактора роста фибробластов 23 (FGF-23) в сыворотке крови. Кальцитриол, попадая в ядро клеток кальциевых каналов, взаимодействует с гетеродимером, который образован рецептором витамина-D (vitamin D receptor — VDR) и х-рецептором ретиноевой кислоты (retinoicacid x-receptor — RXR). Образование комплекса 1,25(OH)2D/VDR/RXR обусловливает взаимодействие VDR с витамин D-регуляторными элементами промоторных областей целевых генов, что приводит к усилению их транскрипции, в частности генов, влияющих на обмен кальция, — гена переходного рецепторного потенциального катионного канала, подсемейства V, 6-го члена (transient receptor potential cation channel, subfamily V, member 6 — TRPV6), гена кальций-связывающего белка (calcium-bindingprotein — CaBP) кальбиндина 9K. Продукты данных генов обеспечивают увеличение абсорбции ионов Са 2+ в тонком кишечнике.
Достаточный уровень концентрации ионов Са 2+ и HPO4 -2 в сыворотке крови обеспечивает адекватную минерализацию костной ткани. В остеобластах 1,25(OH)2D индуцирует экспрессию трансмембранного лиганда рецептора активатора ядерного фактора kB (receptor activator of nuclearfactor-kBligand — RANKL). Остеобластный RANKL, взаимодействуя с рецептором RANK преостеокластов, индуцирует их созревание в зрелые остеокласты. Зрелые остеокласты участвуют в резорбции Са 2+ и фосфора из костной ткани для поддержания их концентрации в сыворотке крови. Увеличение продукции 1,25(OH)2D происходит до некоторого метаболического момента. При достижении определенного уровня концентрации 1,25(OH)2D в сыворотке крови он по принципу обратной связи ингибирует собственную продукцию. В основе данной отрицательной обратной связи лежит подавление VDR экспрессии гена CYP27B1. Кроме того, 1,25(OH)2D индуцирует продукцию остеоцитами FGF-23, который ингибирует синтез паратгормона [3, 24, 26, 38]. Под влиянием 1,25(OH)2D увеличивается экспрессия 24-гидроксилазы, превращающей кальцитриол в биологически неактивную кальцитроевую кислоту, которая выделяется с желчью. Период полувыведения витамина D из организма составляет около 19 дней. Он выводится путем экскреции с желчью, первоначально в кишечник (15-30% от введенной дозы в течение суток), где подвергается энтерогепатической циркуляции (повторное всасывание). Оставшаяся часть выводится с содержимым кишечника. Скорость исчезновения исходного витамина из плазмы крови составляет 19-25 часов, но при накоплении в тканях время его пребывания в организме может составить до 6 месяцев.
Всасывание в кишечнике витамина D, содержащегося в препаратах, обязательно происходит при участии и желчных кислот, и жирных кислот за счет мицеллообразования (эмульгации). Мицеллы — наночастицы с «жировой начинкой» (содержащей витамин D) и гидрофильной оболочкой, которая позволяет наночастицам равномерно распределяться по всему объему водного раствора [14]. Мицеллированная форма витамина D важна потому, что его усвоение в кишечнике происходит только при участии желчных кислот (что подразумевает образование мицелл). У пациентов с муковисцидозом, холестазом и другими нарушениями функции печени (стеатогепатитом и др.) или при соблюдении определенных диет секреция желчных кислот снижается. Это затрудняет мицеллообразование и, следовательно, резко снижает усвоение витамина D (в т.ч. из масляных растворов) и других жирорастворимых витаминов. Пальмитаты в составе маргарина и свиного жира могут также тормозить всасывание витамина. Мицеллированные («водорастворимые») растворы витамина D (Аквадетрим) обеспечивают хорошую степень всасывания практически во всех возрастных группах пациентов (дети, взрослые, пожилые) с минимальной зависимостью от состава диеты, приема препаратов, состояния печени и биосинтеза желчных кислот
Таким образом, роль метаболитов витамина D не ограничивается лишь регуляцией уровня кальция. В условиях целостного организма влияние метаболитов витамина D многогранно и обусловлено сложным взаимодействием большой группы факторов, биологические функции витамина D в организме многообразны, а геномные и негеномные эффекты витамина многочисленны.
Результаты многочисленных исследований свидетельствуют о том, что снижение пребывания на солнце в течение последних 40 лет приводит человечество к большинству болезней во всем мире. Достоверно доказано, что увеличение обеспеченности витамина D снижает частоту диабета, остеопороза, респираторных заболеваний, артериальной гипертензии, аутоиммунных и онкологических заболеваний (молочной железы, кишечника, простаты). С низким уровнем витамина D связывают развитие аллергических заболеваний, болезней сердца, метаболического синдрома и ожирения [39, 40].
Профилактические дозы витамина D у детей и взрослых, вероятно, будут увеличены [41, 42]. Применяемые сейчас 500 МЕ в сутки достаточны для поддержания оптимального уровня метаболизма Са и Р, но недостаточны для реализации некальциемических функций холекальциферола. «Enough for the bones, not for the body» — «Достаточно для кости, но недостаточно для тела».
1. Риггз Б.Л., Мелтон Л.Дж. Остеопороз. Этиология, диагностика, лечение. Пер с англ. — М. — СПб: Издательство БИНОМ: «Невский диалект», 2000. — 560 с.
2. Шварц Г.Я. Витамин D и D-гормон. — М.: Анахарсис, 2005. — 152 с.
3. Gupta V. Vitamin D: Extra-skeletal effects // J Med Nutr Nutraceut. 2012;1:17-26.
4. Cannell J., Hollis B. Use of vitamin D in clinical practice // Alternative medicine review. — 2008. — Vol. 13, №1. — Р. 6-20.
5. D. McCarthy, P. Duggan, M. O’Brien. Alimentary Pharmacology & Therapeutics. — 2005. — Vol. 21, Issue 9. — P. 1073-1083.
6. Camille E. Powe, Michele K. Evans, Julia Wenger et al. Vitamin D–Binding Protein and Vitamin D Status of Black Americans and White Americans // N Engl J Med. — 2013;369:1991-2000.
7. Kebashni Thandrayen, John M. Pettifor. Endocrinology and Metabolism // Clinics of North Americа. — 2010. — Vol. 39, Issue 2. — Р. 303-320.
8. Kienreich K., Grübler M., Tomaschitz A., Schmid J., Verheyen N., Rutters F., Dekker J.M., Pilz S. Vitamin D, arterial hypertension & cerebrovascular disease // Indian J Med Res, 2013;137:669-79.
9. Kate A. Ward, Geeta Das, Jacqueline L. Berry et al. Vitamin D Status and Muscle Function in Post-Menarchal Adolescent Girls // J Clin Endocrinol Metab. — 2009. — Vol. 94. — Р. 559-563.
10. Baeke F., Takiishi T., Korf H, Gysemans C., Mathieu C. Vitamin D: modulator of the immune system // Curr Opin Pharmacol. — 2010;10,Issue 4:482-496.
11. Bartley J. Vitamin D, innate immunity and upper respiratory tract infection // J Laryngol Otol. — 2010,124(5):465-9.
12. Khoo A.L., Chai L., Koenen H., Joosten I., Netea M., van der Ven A. Translating the role of vitamin D3 in infectious diseases // Crit. Rev. Microbiol. — 2012;38(2):122-135.
13. Jørgensen S.P., Agnholt J., Glerup H.. Clinical trial: vitamin D3 treatment in Crohn’s disease – a randomized double-blind placebo-controlled study // Alimentary Pharmacology & Therapeutics. — 2010, Vol. 32, Issue 3, р. 377-383.
14. Громова О.А. Торшин И.Ю., Пронин А.В. Особенности фармакологии водорастворимой формы витамина D на основе мицелл. В печати.
15. Holick M.F. Vitamin D deficiency // N Engl J Med.2007;357:266-81.
16. Prosser, D.E., Jones, G. Enzymes involved in the activation and inactivation of vitamin D // Trends Biochem Sci. 2004; 29: 12: 664-673.
17. Мальцев С.В., Архипова Н.Н., Шакирова Э.М. Витамин D, кальций и фосфаты у здоровых детей и при патологии. — 2012, Казань, 120 с.
18. Мальцев С.В. Рахит // Рациональная фармакотерапия детских заболеваний. — М.: Литтерра, 2007. — С. 285-297.
19. Weber F. Absorption mechanisms for fat-soluble vitamins and the effect of other food constituents // Prog Clin Biol Res. — 1981;77:119-135.
20. Carter G.D., Phinney K.W. Assessing Vitamin D Status: Time for a Rethink? // Clinical Chemistry. — June 2014, vol. 60, no. 6, 809-811.
21. Camille E. Powe, Michele K. Evans, Julia Wenger et al. Vitamin D — Binding Protein and Vitamin D Status of Black Americans and White Americans // N Engl J Med. — 2013;369:1991-2000.
22. Bikle D. Vitamin D and Immune Function: Understanding Common Pathways. Curr. Osteoporos. Rep. — 2009;7:58-63.
23. Drocourt L., Ourlin J.C., Parcussi J.M. et al. Expression of CYP3A4, CYP2B6, and CYP2C9 is regulated by the vitamin D receptor pathway in primary human hepatocytes // J. Biol. Chem. — 2002;277:28:251:25-32.
24. Руснак Ф.И. Витамин D и прогрессирование заболеваний почек // Вестник научно-технического развития. — 2009. — № 11 (27). — С. 52-64.
25. Zehnder D., Bland R., Williams M.C. et al. Extrarenal expression of 25-hydroxyvitamin D3-1alphahydroxylase // Journal of Clinical Endocrinology and Metabolism. — 2001. — Р. 86.
26. Holick M.F. Vitamin D and Healht: Evolution, Biologic, Functions, and Recommended Dietary Intakes for Vitamin D // Clinic Rev. Bone. Miner. Metab. — 2009. — 7. — Р. 2-19.
27. Мальцев С.В., Архипова Н.Н. Витамин D в практике педиатра // Практическая медицина. — 2008. — № 06(08). — С. 12-23.
28. Спиричев В.Б. О биологических эффектах витамина D // Педиатрия. — 2011. — Т. 90, № 6. — С. 113-119.
29. Norman A.W., Bouillon R. Vitamin D nutritional policy needs a vision for the future // Exp. Biol. Med. — 2010. — Vol. 235 (9). — Р. 1034-1045.
30. Adams J.S. Update in Vitamin D // J. Clin. Endocrinol. Metab. — 2010. — Vol. 95. — Р. 471-478.
31. Bikle D. Nonclassic actions of Vitamin D // J. Clin. Endocrinol. Metab. — 2009. — Vol. 94. — Р. 26-34.
32. Sun J. Vitamin D and mucosal immune function // Curr. Opin. Gastroenterol. — 2010. — Vol. 26. — Р. 591-595.
33. Sivri S.K. Vitamin D metabolism // Calcium and vitamin D metabolism / ITA. — 2010. — Р. 256.
34. Захарова И.Н., Коровина Н.А., Боровик Т.Э., Дмитриева Ю.А. Рахит и гиповитаминоз D. Новый взгляд на давно существующую проблему. Пособие для врачей-педиатров. — Москва, 2010. — 96 с.
35. Mosekilde L. Vitamin D and the Elderly // Clin Endocrinol. — 2005. — Vol. 623. — Р. 265-281.
36. Реушева С.В., Паничева Е.А., Пастухова С.Ю., Реушев М.Ю. Значение дефицита витамина D в развитии заболеваний человека // Успехи современного естествознания. — 2013. — №11. — С. 27-31.
37. Schwalfenberg G.K . A review of the critical role of vitamin D in the functioning of the immune system and the clinical implications of vitamin D deficiency // Mol. Nutr. Food Res. — 2011. — Vol. 55, № 1. — Р. 96-108.
38. Крохина К.Н., Смирнов И.Е., Кучеренко А.Г., Беляева И.А. Динамика маркеров остеогенеза у новорожденных детей в норме и при патологии // Вопросы диагностики в педиатрии. — 2011. — Т. 3, № 4. — С. 28-32.
39. Chowdhury R et al. Vitamin D and risk of cause specific death: Systematic review and meta-analysis of observational cohort and randomised intervention studies // BMJ 2014 Apr 1. — Vol. 348. — g1903.
40. www.vitamindwiki.com, 2013.
41. Marshall T.G. Vitamin D discovery outpaces FDA decision making // Bio Essays, 2008. — Vol. 30, № 2. — Р. 173-182.
42. Vieth R., Bischoff-Ferrari H., Boucher B.J. The urgent need to recommend an intake of vitamin D that is effective // J. Clin. Nutr. — 2007. — Vol. 85, № 3. — Р. 649-650.
1. Riggz B.L., Melton L.Dzh. Osteoporoz. Etiologiya, diagnostika, lechenie [Osteoporosis. Etiology, diagnosis, treatment]. Moscow; Saint Petersburg: Izdatel’stvo BINOM: “Nevskiy dialect”, 2000. 560 p.
2. Shvarts G.Ya. Vitamin D i D-gormon [Vitamin D and D-hormone]. Moscow: Anakharsis, 2005. 152 p.
3. Gupta V. Vitamin D: Extra-skeletal effects. J Med Nutr Nutraceut. 2012;1:17-26.
4. Cannell J., Hollis B. Use of vitamin D in clinical practice. Alternative medicine review, 2008, vol. 13, no. 1, rr. 6-20.
5. D. McCarthy, P. Duggan, M. O’Brien. Alimentary Pharmacology & Therapeutics, 2005, vol. 21, issue 9, pp. 1073-1083.
6. Camille E. Powe, Michele K. Evans, Julia Wenger et al. Vitamin D-Binding Protein and Vitamin D Status of Black Americans and White Americans. N Engl J Med., 2013;369:1991-2000.
7. Kebashni Thandrayen, John M. Pettifor. Endocrinology and Metabolism. Clinics of North America, 2010, vol. 39, issue 2, rr. 303-320.
8. Kienreich K., Grübler M., Tomaschitz A., Schmid J., Verheyen N., Rutters F., Dekker J.M., Pilz S. Vitamin D, arterial hypertension & cerebrovascular disease. Indian J Med Res, 2013;137:669-79.
9. Kate A. Ward, Geeta Das, Jacqueline L. Berry et al. Vitamin D Status and Muscle Function in Post-Menarchal Adolescent Girls. J Clin Endocrinol Metab., 2009, vol. 94, rr. 559-563.
10. Baeke F., Takiishi T., Korf H, Gysemans C., Mathieu C. Vitamin D: modulator of the immune system. Curr Opin Pharmacol., 2010;10,Issue 4:482-496.
11. Bartley J. Vitamin D, innate immunity and upper respiratory tract infection. J Laryngol Otol., 2010, 124(5):465-9.
12. Khoo A.L., Chai L., Koenen H., Joosten I., Netea M., van der Ven A. Translating the role of vitamin D3 in infectious diseases. Crit. Rev. Microbiol., 2012; 38(2):122-135.
13. Jørgensen S.P., Agnholt J., Glerup H.. Clinical trial: vitamin D3 treatment in Crohn’s disease – a randomized double-blind placebo-controlled study. Alimentary Pharmacology & Therapeutics, 2010, vol. 32, issue 3, rr. 377-383.
14. Gromova O.A. Torshin I.Yu., Pronin A.V. Osobennosti farmakologii vodorastvorimoy formy vitamina D na osnove mitsell [Pharmacology of water-soluble form of vitamin D on the basis of the micelles].
15. Holick M.F. Vitamin D deficiency. N Engl J Med., 2007;357:266-81.
16. Prosser, D.E., Jones, G. Enzymes involved in the activation and inactivation of vitamin D. Trends Biochem Sci. 2004; 29: 12: 664-673.
17. Mal’tsev S.V., Arkhipova N.N., Shakirova E.M. Vitamin D, kal’tsiy i fosfaty u zdorovykh detey i pri patologii [Vitamin D, calcium and phosphate in healthy children and in pathology]. Kazan, 2012, 120 p.
18. Mal’tsev S.V. Rakhit [Rickets]. Ratsional’naya farmakoterapiya detskikh zabolevaniy. Moscow: Litterra, 2007. Pp. 285-297.
19. Weber F. Absorption mechanisms for fat-soluble vitamins and the effect of other food constituents. Prog Clin Biol Res. 1981;77:119-135.
20. Carter G.D., Phinney K.W. Assessing Vitamin D Status: Time for a Rethink? Clinical Chemistry, June 2014, vol. 60, no. 6, pp. 809-811.
21. Camille E. Powe, Michele K. Evans, Julia Wenger et al. Vitamin D-Binding Protein and Vitamin D Status of Black Americans and White Americans. N Engl J Med., 2013;369:1991-2000.
22. Bikle D. Vitamin D and Immune Function: Understanding Common Pathways. Curr. Osteoporos. Rep., 2009;7:58-63.
23. Drocourt L., Ourlin J.C., Parcussi J.M. et al. Expression of CYP3A4, CYP2B6, and CYP2C9 is regulated by the vitamin D receptor pathway in primary human hepatocytes. J. Biol. Chem., 2002;277:28:251:25-32.
24. Rusnak F.I. Vitamin D and progression of kidney disease. Vestnik nauchno-tekhnicheskogo razvitiya, 2009, no. 11 (27), pp. 52-64 (in Russ.).
25. Zehnder D., Bland R., Williams M.C. et al. Extrarenal expression of 25-hydroxyvitamin D3-1alphahydroxylase. Journal of Clinical Endocrinology and Metabolism, 2001, r. 86.
26. Holick M.F. Vitamin D and Healht: Evolution, Biologic, Functions, and Recommended Dietary Intakes for Vitamin D. Clinic Rev. Bone. Miner. Metab., 2009, 7, rr. 2-19.
27. Mal’tsev S.V., Arkhipova N.N. Vitamin D in pediatric practice. Prakticheskaya meditsina, 2008, no. 06(08), pp. 12-23 (in Russ.).
28. Spirichev V.B. On the biological effects of vitamin D. Pediatriya, 2011, vol. 90, no. 6, pp. 113-119 (in Russ.).
29. Norman A.W., Bouillon R. Vitamin D nutritional policy needs a vision for the future. Exp. Biol. Med., 2010, vol. 235 (9), rr. 1034-1045.
30. Adams J.S. Update in Vitamin D. J. Clin. Endocrinol. Metab., 2010, vol. 95, rr. 471-478.
31. Bikle D. Nonclassic actions of Vitamin D. J. Clin. Endocrinol. Metab., 2009, vol. 94, rr. 26-34.
32. Sun J. Vitamin D and mucosal immune function. Curr. Opin. Gastroenterol., 2010, vol. 26, rr. 591-595.
33. Sivri S.K. Vitamin D metabolism. Calcium and vitamin D metabolism. ITA., 2010, rr. 256.
34. Zakharova I.N., Korovina N.A., Borovik T.E., Dmitrieva Yu.A. Rakhit i gipovitaminoz D. Novyy vzglyad na davno sushchestvuyushchuyu problemu. Posobie dlya vrachey-pediatrov [Rickets and vitamin deficiencies D. A new look at the long-standing problem. Allowance for pediatricians]. Moscow, 2010. 96 p.
35. Mosekilde L. Vitamin D and the Elderly. Clin Endocrinol., 2005, vol. 623, rr. 265-281.
36. Reusheva S.V., Panicheva E.A., Pastukhova S.Yu., Reushev M.Yu. The value of vitamin D deficiency in the development of human diseases. Uspekhi sovremennogo estestvoznaniya, 2013, no.11, pp. 27-31 (in Russ.).
37. Schwalfenberg G.K . A review of the critical role of vitamin D in the functioning of the immune system and the clinical implications of vitamin D deficiency. Mol. Nutr. Food Res., 2011, vol. 55, no. 1, rr. 96-108.
38. Krokhina K.N., Smirnov I.E., Kucherenko A.G., Belyaeva I.A. Dynamics of markers of bone formation in newborn infants in normal and pathological conditions. Voprosy diagnostiki v pediatrii, 2011, vol. 3, no. 4, pp. 28-32 (in Russ.).
39. Chowdhury R et al. Vitamin D and risk of cause specific death: Systematic review and meta-analysis of observational cohort and randomised intervention studies. BMJ. 2014, Apr 1, vol. 348, g1903.



