Витамин К — редуктаза (VKORC1). Выявление мутации C(-1639)T (регуляторная область гена)
Маркер связан с изменением метаболизма витамина К и чувствительности к варфарину. Исследуется при расчете эффективности лечения варфарином («Варфарексом», «Мареваном») и определении риска кровотечений при нем.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Локализация гена на хромосоме – 16p11.2
Ген VKORC1 кодирует субъединицу 1 витамин К – эпоксид-редуктазного комплекса (vitamin К epoxide reductase complex, subunit 1) – трансмембранного белка, основного фермента цикла витамина К и «мишени» для препарата варфарина.
Генетический маркер C(-1639)T
Участок ДНК гена VKORC1 (регуляторная область), в котором происходит замена цитозина (С) в позиции -1639 на тимин (Т), обозначается как генетический маркер С(-1639)Т.
Встречаемость в популяции
Аллель Т встречается у европейцев с частотой 40 %.
Ассоциация маркера с метаболизмом лекарственных препаратов
Его исследуют, чтобы выявить физиологическую эффективность применения препаратов антикоагулянтов из класса кумаринов (варфарина).
Общая информация об исследовании
Для предупреждения и лечения тромбоэмболических осложнений наиболее часто применяется варфарин («Кумадин»). Он назначается для продолжительного приема в серии случаев, связанных с повышенной свертываемостью крови, а также в послеоперационный период с целью предотвратить образование тромбов из-за хирургического вмешательства. Часто практикуется назначение препарата людям, перенесшим инсульты, инфаркт миокарда.
Ген VKORC1 кодирует субъединицу 1 витамин К – эпоксид-редуктазного комплекса (vitamin К epoxide reductase complex, subunit 1) – трансмембранного белка, основного фермента, активирующего витамин К.
Витамин К поступает в организм человека в неактивной форме, с помощью данного белка происходит его активация, которая необходима для модификации белков свертывающей и противосвертывающей системы крови. Дефицит активированного витамина К может приводить к кровотечениям, особенно на фоне приема варфарина, который ингибирует фермент VKORC, связываясь с ним и блокируя его работу.
Одной из причин дефицита активированного витамина К и замедленного свертывания крови является изменение в гене VKORC1, приводящее к снижению синтеза фермента.
Варианты данного гена определяют скорость синтеза и концентрацию фермента в клетке. Исследуемый полиморфизм проявляется в замене основания цитозина на тимин в регуляторной области гена VKORC1. Наличие нуклеотида тимина в участке -1639 (вариант гена Т) является причиной снижения активности белкового синтеза почти в 2 раза. Таким образом, присутствие варианта гена Т, ассоциированного с дефицитом фермента, на фоне приема стандартных доз варфарина может повлечь за собой кровотечение. Поэтому исследование генетического маркера VKORC1 C(-1639)T очень значимо для определения эффективной и безопасной дозы препарата.
В сочетании с оценкой активности гена VKORC1 для расчета адекватной дозы лекарственных препаратов необходим также анализ генов CYP. Так как для достижения эффекта лекарств необходима их биоактивация в организме (трансформация в активную форму) системой ферментов цитохрома Р450 (CYP), важно исследовать полиморфизм гена CYP2C9. В европейской популяции часто встречаются аллели этого гена, кодирующие образование ферментов со сниженной или отсутствующей функцией, что является причиной осложнений при приеме антикоагуляционных препаратов.
Можно выделить 3 варианта генотипа по маркеру:
- C/C – нормальная концентрация фермента
- C/T – сниженная концентрация фермента
- T/T – низкая концентрация фермента
На основании выявленного генотипа в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными врач может выбрать соответствующую стратегию лечения.
Генетический маркер входит в исследование:
Для данного маркера не существует понятия «норма» и «патология», т. к. исследуется полиморфизм гена.
Витамин К — редуктаза (VKORC1). Выявление мутации C(-1639)T (регуляторная область гена)
Локализация гена на хромосоме – 16p11.2
Ген VKORC1 кодирует субъединицу 1 витамин К – эпоксид-редуктазного комплекса (vitamin К epoxide reductase complex, subunit 1) – трансмембранного белка, основного фермента цикла витамина К и «мишени» для препарата варфарина.
Генетический маркер C(-1639)T
Участок ДНК гена VKORC1 (регуляторная область), в котором происходит замена цитозина (С) в позиции -1639 на тимин (Т), обозначается как генетический маркер С(-1639)Т.
Встречаемость в популяции
Аллель Т встречается у европейцев с частотой 40 %.
Ассоциация маркера с метаболизмом лекарственных препаратов
Его исследуют, чтобы выявить физиологическую эффективность применения препаратов антикоагулянтов из класса кумаринов (варфарина).
Общая информация об исследовании
Для предупреждения и лечения тромбоэмболических осложнений наиболее часто применяется варфарин («Кумадин»). Он назначается для продолжительного приема в серии случаев, связанных с повышенной свертываемостью крови, а также в послеоперационный период с целью предотвратить образование тромбов из-за хирургического вмешательства. Часто практикуется назначение препарата людям, перенесшим инсульты, инфаркт миокарда.
Ген VKORC1 кодирует субъединицу 1 витамин К – эпоксид-редуктазного комплекса (vitamin К epoxide reductase complex, subunit 1) – трансмембранного белка, основного фермента, активирующего витамин К.
Витамин К поступает в организм человека в неактивной форме, с помощью данного белка происходит его активация, которая необходима для модификации белков свертывающей и противосвертывающей системы крови. Дефицит активированного витамина К может приводить к кровотечениям, особенно на фоне приема варфарина, который ингибирует фермент VKORC, связываясь с ним и блокируя его работу.
Одной из причин дефицита активированного витамина К и замедленного свертывания крови является изменение в гене VKORC1, приводящее к снижению синтеза фермента.
Варианты данного гена определяют скорость синтеза и концентрацию фермента в клетке. Исследуемый полиморфизм проявляется в замене основания цитозина на тимин в регуляторной области гена VKORC1. Наличие нуклеотида тимина в участке -1639 (вариант гена Т) является причиной снижения активности белкового синтеза почти в 2 раза. Таким образом, присутствие варианта гена Т, ассоциированного с дефицитом фермента, на фоне приема стандартных доз варфарина может повлечь за собой кровотечение. Поэтому исследование генетического маркера VKORC1 C(-1639)T очень значимо для определения эффективной и безопасной дозы препарата.
В сочетании с оценкой активности гена VKORC1 для расчета адекватной дозы лекарственных препаратов необходим также анализ генов CYP. Так как для достижения эффекта лекарств необходима их биоактивация в организме (трансформация в активную форму) системой ферментов цитохрома Р450 (CYP), важно исследовать полиморфизм гена CYP2C9. В европейской популяции часто встречаются аллели этого гена, кодирующие образование ферментов со сниженной или отсутствующей функцией, что является причиной осложнений при приеме антикоагуляционных препаратов.
VKORC1 (эпоксид редуктаза витамина К)
Физиология и генетика. VKOR (Vitamin K epoxide reductase) — эпоксид редуктаза витамина К – фермент, переводящий витамин К из неактивной (2,3-эпоксид витамин К) в активную форму (витамин К гидрохинолон). Активная форма фермента влияет на выработку К-витамин-зависимых факторов свертывания крови, тем самым, регулируя процесс тромбообразования. Дефицит витамина К может приводить к опасным для жизни кровотечениям, особенно на фоне приема антикоагулянтов кумаринового ряда, например Варфарина. Он блокирует фермент эпоксид редуктазу витамина К, связываясь с субъединицей 1 комплекса (VKORC1), тем самым влияя на синтез факторов свертывания. Это приводит к замедлению процессов коагуляции крови. Определенные мутации в гене VKORC1 ассоциируются с дефицитом фермента, что может повлечь за собой неадекватность терапии Варфарином.
Показания к анализу. Определение индивидуальной дозировки антикоагулянтов ряда кумарина, в частности, варфарина.
Клинические исследования. Rieder MJ et al (2005) [15930419] исследовали 10 полиморфизмов в гене VKORC1 (381, 861, 2653, 3673, 5808, 6009, 6484, 6853, 7566, 9041, нумерация по референс последовательности GenBank AY587020) и их связь с индивидуальной дозировкой варфарина. В ходе исследования, выделено 5 основных гаплотипов, частота встречаемости которых превышала 1%. После расчетов зависимостей генотипа и индивидуальной дозировки, гаплотипы были разделены на группы A (низкая активность VCORC1-низкая доза варфарина) и B (высокая доза). Уровень мРНК VKORC1 в печени при генотипе В/В в 3 раза больше по сравнению с таковым при генотипе А/А, что объясняет механизм эффекта ген-доза. Для расчета индивидуальной среднесуточной дозы препарата, исследователи предложили определять гаплотип пациента, основываясь на генотипировании 4 из 10 исследованных SNP (861, 5808, 6853 и 9041). Полиморфизм 6853 является сцепленным с мутациями в точках 381, 3673, 6484, 7566 (коэф. корреляции r2 >0.9), которые определяют принадлежность к группе А. Таким образом для определения группы А достаточно убедится в наличии хотя бы одной мутации в любой из пяти точек 381, 3673, 6484, 6853 или 7566. Было показано, что индивидуальная дозировка Варфарина для генотипов А/А, А/В и В/В равна 2.7±0.2, 4.9±0.2 и 6.2±0.3 мг/сутки, соответственно.
Полиморфизмы CYP2C9 оказывают влияние, примерно в 10-15% случаев, а полиморфизмы VKORC1 — на 25-30% вариаций дозы варфарина. Наличие мутантного генотипа CYP2C9 при наличии варианта A/A VKORC1 незначительно влияет на оптимальную дозу препарата. Вероятно, наличие полиморфизмов в данных генах необходимо рассматривать как независимые факторы, требующие снижения дозы препарата.
Schwarz UI et al (2008) [18322281] исследовали зависимость дозы варфарина от генотипа А и не-А VKORC1. Анализировали полиморфизмы в промотерной области 1639G→A или 3673 и в интронном районе 497T→G или 5808, 1173C→T или 6484, 1542G→C или 6853, 2255C→T или 7566. Подтверждена высокая корреляция наличия одновременных мутаций 3673, 6484, 6853, 7566 (r2 >0.85), определяющих группу А малых доз антикоагулянтов ряда кумарина. Обнаружено, что как гаплотип А/А VKORC1, так и генотип CYP2C9 не только определяют время наступления INR>4 (кровотечения), но и существенно влияют на терапевтическую дозу варфарина после первых двух недель терапии.
Частота встречаемости группы А в европейской популяции – 34-40% (гомозиготы А/А – 10%), в азиатской — 89%, в африканской — 14%.
Исследование проведенное во Франции K. Lacut et al.[17883698] показало взаимосвязь полиморфизма С1173Т в гене VKORC1 с риском развития венозной тромбоэмболии. Венозная тромбоэмболия — мультифакторное заболевание, обусловленное взаимодействием многих факторов, включая генетические, приобретенные или транзиторные. В работе приняли участие 878 человек, у 439 из которых был случай венозной тромбоэмболии. Генотип ТТ в группе контроля встречался чаще, чем в группе пациентов с венозной тромбоэмболией (16,2% против 11,2%). Авторы показали протективный эффект генотипа ТТ по отношению к генотипам СТ и СС (OR = 0.58; 95% CI: 0.35–0.97; аллель Т рецессивный; данные после поправки на сердечно-сосудистые заболевания, индекс массы тела, мутации в факторе V и протромбине).
Необходимо учитывать, что эпоксид редуктаза витамина К играет важную роль не только в гемостазе, но и в обызвествлении сосудов. Teichert M. et al.[18218987] проанализировали взаимосвязь полиморфизма С1173Т в гене VKORC1 с обызвествлением артерий. В работе приняло участие 3187 человек. Оказалось, что для носителей хотя бы одного Т-аллеля риск обызвествления увеличивался на 19% (95% СI 2-40%).
Витамин К — редуктаза (VKORC1). Выявление мутации T7481C (регуляторная область гена)
Маркер связан с изменением метаболизма витамина К и чувствительности к варфарину. Исследуется для оценки эффективности лечения варфарином.
Локализация гена на хромосоме – 16p11.2
Ген VKORC1 кодирует субъединицу 1 витамин К — эпоксид-редуктазного комплекса (vitamin К epoxide reductase complex, subunit 1) – трансмембранного белка, основного фермента цикла витамина К и «мишени» для препарата варфарина.
Генетический маркер T7481C
Участок регуляторной области ДНК гена VKORC1, в которой происходит замена нуклеотида тимина (Т) в позиции 7481 на цитозин (С), обозначается как генетический маркер T7481C (альтернативное название – rs2359612 A > G).
Возможные генотипы
Частота встречаемости в популяции
Аллель Т встречается у европейцев с частотой от 37 до 46 %.
Ассоциация маркера с метаболизмом лекарственных препаратов
Исследуется для выявления физиологической эффективности применения препаратов антикоагулянтов из класса кумаринов (варфарина).
Для предупреждения и лечения тромбоэмболических осложнений наиболее часто применяется препарат варфарин («Кумадин»). Он назначается для продолжительного приема в серии случаев, связанных с повышенной свертываемостью крови, а также в послеоперационный период с целью предотвратить образование тромбов вследствие хирургического вмешательства. Часто практикуется назначение препарата людям, перенесшим инсульты, инфаркт миокарда.
Ген VKORC1 кодирует субъединицу 1 витамин К – эпоксид-редуктазного комплекса (vitamin К epoxide reductase complex, subunit 1) – трансмембранного белка, основного фермента, активирующего витамин К.
Витамин К поступает в организм человека в неактивной форме, с помощью данного белка происходит его активация, которая необходима для модификации белков свертывающей и противосвертывающей системы крови. Дефицит активированного витамина К может приводить к кровотечениям, особенно на фоне приема варфарина, который ингибирует фермент VKORC, связываясь с ним и блокируя его работу.
Одной из причин дефицита активированного витамина К и замедления процесса свертывания крови является изменение в гене VKORC1, приводящее к снижению синтеза фермента.
Участок в регуляторной области гена VKORC1 (интрон 2), в которой происходит замена нуклеотида тимина (Т) в позиции 7481 на цитозин (С), обозначается как генетический маркер T7481C (альтернативное название rs2359612 A > G) и приводит к снижению функции фермента, являющегося фармацевтической «мишенью» препаратов группы кумаринов. Поэтому при лечении пациентов варфарином (производное кумарина) важно оценивать влияние полиморфизма гена VKORC1 для расчета адекватной дозы препарата. Так, в исследованиях Arnold ML et al было показано, что достижение терапевтического эффекта варфарина у пациентов с генотипом T/T наблюдалось через 3,2 дня, у пациентов с генотипом Т/С – через 4,4 дня, а у пациентов с генотипом С/С – через 6,5 дней. Таком образом, можно сделать вывод, что аллель Т ассоциирован с возможностью применения меньшей дозы варфарина по сравнению с аллелем C.
В сочетании с оценкой активности гена VKORC1 для расчета адекватной дозы лекарственных препаратов необходим также анализ генов CYP. Так как для достижения эффекта лекарственных препаратов в организме нужна их биоактивация (трансформация в активную форму) системой ферментов цитохрома Р450 (CYP), важно исследовать полиморфизм гена CYP2C9. В европейской популяции часто встречаются аллели этого гена, кодирующие образование ферментов со сниженной или отсутствующей функцией, что является причиной осложнений на фоне приема антикоагуляционных препаратов.
Можно выделить 3 варианта генотипа:
- Т/Т – пациентам с генотипом ТТ, проходящим лечение варфарином, требуется меньшая доза препарата, по сравнению с пациентами с генотипами ТС и СС;
- Т/С – пациентам с генотипом ТС, проходящим лечение варфарином, требуется меньшая доза препарата, по сравнению с пациентами с генотипом СС;
- С/С – пациентам с генотипом СС, проходящим лечение варфарином, требуется большая доза препарата, по сравнению с пациентами с генотипами ТС и ТТ.
На основании выявленного генотипа в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными врач может выбрать соответствующую стратегию лечения.
Для данного маркера не существует понятия «норма» и «патология», т. к. исследуется полиморфизм гена.
- Arnold ML, Grond-Ginsbach C, Kloss M, Di Mascio MT, Veltkamp R, Ringleb P, Lichy C. Pharmacogenetic testing for guiding de novo phenprocoumon therapy in stroke patients.Cerebrovasc Dis. 2009;28(5):468-71.
Подписка на новости
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed
G1639a в гене vkorc 1 ген эпоксидредуктазы витамина к
Антикоагулянт варфарин — пероральный препарат, обычно используемый для предотвращения тромбоэмболии. Механизм действия — ингибирование субъединицы I комплекса эпоксидредуктазы витамина К (кодируемого геном VKORC1), обеспечивающего редукцию витамина К, необходимую для его повторного использования в биосинтезе фактора свертывания.
Витамин К — эссенциальный кофактор карбоксилирования боковых цепей остатков глутаминовой кислоты в факторах свертывания II, VII, IX и X — посттрансляционной модификации, необходимой для биоактивности этих факторов в каскаде свертывания. Более 20 000 000 пациентов в год получают варфарин только в США. Данные разных исследований показывают, что у людей на варфаринотерапи годовой уровень фатальных кровотечений составляет от 0,1 до 1%, а тяжелые кровотечения — от 0,5 до 6,5%.
Таким образом, необходима регулярная тщательная проверка антикоагулянтного статуса, чтобы убедиться в том, что время светрывания крови находится в пределах терапевтических колебаний, необходимых для предотвращения тромбоэмболии.
Подбор терапевтической дозы варфарина для пациента усложняется как генетическими, так и средовыми факторами. Диета и медикаменты могут изменять доступность витамина К вследствие его поступления с пищей или синтеза флорой толстого кишечника. Многие медикаменты вмешиваются в обмен варфарина в I фазу метаболизма, что также может влиять на дозу, необходимую для достижения терапевтического уровня.
Риск кровотечения наиболее велик в течение первых нескольких месяцев после начала терапии, когда дозу корректируют методом проб и ошибок в соответствии с измерениями времени свертывания у пациента. Кроме особенностей питания и лекарственных взаимодействий, изменчивость индивидуального ответа на варфарин имеет также генетическую основу в полиморфизме как метаболизма варфарина, так и его биологической цели.
Наиболее активный метаболит варфарина проходит I фазу детоксикации с помощью цитохрома CYP2C9. Суммарная частота аллелей, вызывающих недостаточность CYP2C9, — 20% у европеоидов, только 3,5% у афроамериканцев и менее чем 2% у монголоидов. Гетерозиготам по аллелям недостаточности показана в среднем на 20% более низкая доза варфарина для поддержания той же степени свертывания. Учет генотипа CYP2C9 пациента для подбора дозы может уменьшить время, необходимое для достижения стабильного режима дозирования после начала терапии.
Варианты CYP2C9 определяют, однако, менее половины генетической изменчивости ответа на терапию варфарином. Дополнительная изменчивость вызвана аллельными вариантами в объекте воздействия варфарина — ферменте VKORC1. Частые аллели SNP в некодирующих последовательностях гена VKORC1 могут использоваться для выделения двух основных гаплотипов, А и В, заметно отличающихся по дозе варфарина, необходимой для достижения и поддержания необходимого антикоагулянтного эффекта.
В одном исследовании показано, что у гомозигот А/А терапевтическая доза составляла 3,2 мг/ сут, у В/В — 6,1 мг/сут, а у гетерозигот А/В — промежуточная доза 4,4 мг/сут. С помощью какого механизма эти гаплотипы изменяют чувствительность к варфарину, полностью не известно, но гаплотип В определяет троекратное увеличение уровня мРНК гена VKORC1. Если допустить, что уровни фермента связаны с уровнем мРНК, троекратное увеличение количества мРНК приводит к троекратному увеличению количества синтезируемого фермента, таким образом требуя более высокой дозы варфарина для достижения той же степени блокады повторного использования витамина К.
Частота разных гаплотипов VKORC1 сильно отличается в разных этнических группах; более чувствительный гаплотип А встречается у 33% европеоидов, 89% монголоидов и 14% африканцев. Полиморфизм VKORC1 может объяснить интересное клиническое наблюдение, что пациенты азиатского происхождения более чувствительны к малым дозам варфарина, чем африканского или европейского происхождения.
Объединяя генотипы CYP2C9 и VKORC1, можно объяснить почти половину межиндивидуальных различий в необходимой дозе варфарина. Гомозиготам по аллелям CYP2C9 и VKORC1 со сниженной активностью для достижения терапевтического ответа показана одна пятая и даже одна шестая дозы варфарина, оптимальная для гомозигот по нормальным аллелям.
Витамин К — редуктаза (VKORC1). Выявление мутации T7481C (регуляторная область гена)
Маркер связан с изменением метаболизма витамина К и чувствительности к варфарину. Исследуется для оценки эффективности лечения варфарином.
Полимеразная цепная реакция.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Локализация гена на хромосоме – 16p11.2
Ген VKORC1 кодирует субъединицу 1 витамин К — эпоксид-редуктазного комплекса (vitamin К epoxide reductase complex, subunit 1) – трансмембранного белка, основного фермента цикла витамина К и «мишени» для препарата варфарина.
Генетический маркер T7481C
Участок регуляторной области ДНК гена VKORC1, в которой происходит замена нуклеотида тимина (Т) в позиции 7481 на цитозин (С), обозначается как генетический маркер T7481C (альтернативное название – rs2359612 A > G).
Встречаемость в популяции
Аллель Т встречается у европейцев с частотой от 37 до 46 %.
Ассоциация маркера с метаболизмом лекарственных препаратов
Исследуется для выявления физиологической эффективности применения препаратов антикоагулянтов из класса кумаринов (варфарина).
Общая информация об исследовании
Для предупреждения и лечения тромбоэмболических осложнений наиболее часто применяется препарат варфарин («Кумадин»). Он назначается для продолжительного приема в серии случаев, связанных с повышенной свертываемостью крови, а также в послеоперационный период с целью предотвратить образование тромбов вследствие хирургического вмешательства. Часто практикуется назначение препарата людям, перенесшим инсульты, инфаркт миокарда.
Ген VKORC1 кодирует субъединицу 1 витамин К – эпоксид-редуктазного комплекса (vitamin К epoxide reductase complex, subunit 1) – трансмембранного белка, основного фермента, активирующего витамин К.
Витамин К поступает в организм человека в неактивной форме, с помощью данного белка происходит его активация, которая необходима для модификации белков свертывающей и противосвертывающей системы крови. Дефицит активированного витамина К может приводить к кровотечениям, особенно на фоне приема варфарина, который ингибирует фермент VKORC, связываясь с ним и блокируя его работу.
Одной из причин дефицита активированного витамина К и замедления процесса свертывания крови является изменение в гене VKORC1, приводящее к снижению синтеза фермента.
Участок в регуляторной области гена VKORC1 (интрон 2), в которой происходит замена нуклеотида тимина (Т) в позиции 7481 на цитозин (С), обозначается как генетический маркер T7481C (альтернативное название rs2359612 A > G) и приводит к снижению функции фермента, являющегося фармацевтической «мишенью» препаратов группы кумаринов. Поэтому при лечении пациентов варфарином (производное кумарина) важно оценивать влияние полиморфизма гена VKORC1 для расчета адекватной дозы препарата. Так, в исследованиях Arnold ML et al было показано, что достижение терапевтического эффекта варфарина у пациентов с генотипом T/T наблюдалось через 3,2 дня, у пациентов с генотипом Т/С – через 4,4 дня, а у пациентов с генотипом С/С – через 6,5 дней. Таком образом, можно сделать вывод, что аллель Т ассоциирован с возможностью применения меньшей дозы варфарина по сравнению с аллелем C.
В сочетании с оценкой активности гена VKORC1 для расчета адекватной дозы лекарственных препаратов необходим также анализ генов CYP. Так как для достижения эффекта лекарственных препаратов в организме нужна их биоактивация (трансформация в активную форму) системой ферментов цитохрома Р450 (CYP), важно исследовать полиморфизм гена CYP2C9. В европейской популяции часто встречаются аллели этого гена, кодирующие образование ферментов со сниженной или отсутствующей функцией, что является причиной осложнений на фоне приема антикоагуляционных препаратов.
Можно выделить 3 варианта генотипа:
- Т/Т – пациентам с генотипом ТТ, проходящим лечение варфарином, требуется меньшая доза препарата, по сравнению с пациентами с генотипами ТС и СС;
- Т/С – пациентам с генотипом ТС, проходящим лечение варфарином, требуется меньшая доза препарата, по сравнению с пациентами с генотипом СС;
- С/С – пациентам с генотипом СС, проходящим лечение варфарином, требуется большая доза препарата, по сравнению с пациентами с генотипами ТС и ТТ.
На основании выявленного генотипа в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными врач может выбрать соответствующую стратегию лечения.
Для данного маркера не существует понятия «норма» и «патология», т. к. исследуется полиморфизм гена.
Полиморфизмы фактора VII и эпоксид-редуктазы витамина K в клинической практике
Фактор VII является одним из ключевых факторов в каскаде свертывания крови. Он относится к факторам свертывания крови, зависимым от витамина K. Уяснение роли VII фактора в свертывании крови и значения витамина K для нормальной коагуляции открывает путь к пониманию важнейших механизмов, лежащих в основе поддержания нормальной активности системы гемостаза, и механизмов развития патологии, приводящей к повышению риска кровотечений и тромбозов. Наследственные дефекты генов фактора VII и ферментов, участвующих в превращении витамина K могут влиять не только на риск тромбозов и кровотечений, но и на формирование плаценты и плацентарного кровообращения, риск осложнений беременности. Опыт показывает, что не только пациенты, но и многие врачи испытывают трудности с интерпретацией анализов на полиморфизм генов системы гемостаза. Надеемся, что данная статья окажется полезной врачам и пациентам, поможет улучшить качество подготовки к беременности и ведения беременности у женщин высокого риска осложнений беременности. Еще одной целевой аудиторией данной статьи являются врачи, ведущие пациентов с риском сосудистых и тромботических осложнений (терапевты, кардиологи, хирурги, педиатры).
Фактор VII. Общие понятия
Свертывание крови в норме является тонко регулируемой системой, обеспечивающей, с одной стороны, поддержание в жидком состонии крови внутри сосудов, но, с другой стороны, быстро включающейся в ответ на повреждение сосудов, предотвращая кровопотерю. Нормальное состояние крови поддерживается разнонаправленными механизмами, одни из которых обеспечивают активацию, а другие — торможение свертывания крови. При избыточной активности механизмов, способствующих коагуляции и при недостаточной активности механизмов, препятсвующих коагуляции появляется риск тромбозов — образование сгустков крови внутри сосудов, затрудняющих нормальное кровообращение. При противоположных ситуациях повышается риск кровотечений.
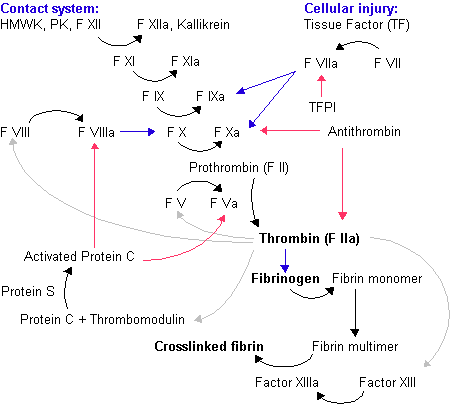
Фактор VII стоит в самом начале цепочки реакций самоусиления (каскадных реакций), в конечном итоге приводящих к образованию сгустка фибрина. Он был впервые открыт независимо друг от друга двумя группами исследователей в 1949 и в 1951 г. и имеет несколько синонимов, самым распространенным из которых является проконвертин. Фактор VII является гликопротеином, относящимся к группе витамин-K-зависимых сериновых протеаз. Он играет ключевую роль в свертывании крови. Другими витамин K-зависимыми факторами являются протромбин, факторы IX и X, а также протеины C и S.
Активация фактора VII происходит под воздействием тканевого фактора. Тканевой фактор является гликопротеином мембраны клетки, который в нормальных условиях «спрятан» под мембраной и поэтому не экспрессируется на поверхности выстилки сосудов. При повреждении стенки сосуда тканевой фактор попадает в кровь и начинает взаимодействовать с небольшими количествами активного (VIIa) и неактивного (VII) фактора VII. Это соединение резко ускоряет превращение фактора VII в фактор VIIa. Фактор VIIa в соединении с тканевым фактором в присутствии кальция и фосфолипидов облегчает превращение фактора IX в фактор IXa и фактора X в фактор Xa. Такая активация свертывания крови традиционно называется внешним путем активации гемостаза. Таким образом, комплекс фактора VIIa с тканевым фактором является мощным активаторов факторов IX и X.
Фактор VII имеет самый короткий период полужизни (6-8 часов) по сравнению со всеми другими факторами свертывания крови, поэтому при возникновении таких проблем, как нарушение функции печени или дефицит витамина K, уровень фактора VII в крови снижается быстрее всех витамин K-зависимых факторов.
Концентрация фактора VII повышается во время беременности у здоровых женщин. Концентрация активного фактора VII у носителей разных генетических вариантов фактора может различаться в несколько раз.
Фактор VII. Генетика и структура.
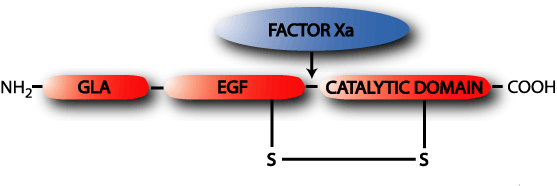
Ген VII фактора расположен на длинном плече 13-й хромосомы (13q34), недалеко от гена фактора X. Фактор VII синтезируется в печени и секретируется в виде гликопротеина, состоящего из одной пептидной цепочки молекулярной массой 48 кД. Подобно остальным витамин K-зависимые зимогенам фактор VII имеет Gla-домен, каталитический домен и домены, подобные эпидермальному фактору роста.
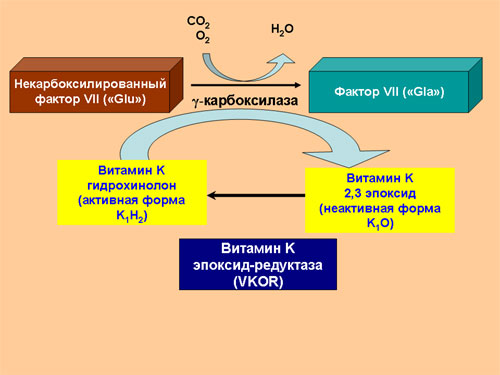
Аббревиатура Gla обозначает остаток гамма-карбоксиглутаминовой кислоты (gamma-carboxyglutamic acid). В синтезируемой внутри клетки белковой цепи фактора VII на N-конце находится 34 остатка глутаминовой кислоты (Glu). После завершения синтеза белка внутри клетки происходит карбоксилирование 10 таких остатков, в результате чего остатки глутаминовой кислоты превращаются в остатки гамма-карбоксиглутаминовой кислоты. Такая модификация белка называется посттрансляционным модифицированием. Пострансляционное модифицирование фактора VII происходит под действием фермента гамма-карбоксилазы в присутствии активной формы витамина K. В результате этой реакции витамин K выступает донором атомов водорода и превращается в неактивную окисленную форму (эпоксид витамина K). Обратное превращение неактивной формы витамина K в активную происходит под действием фермента витамин-K-эпоксид-редуктазы (VKOR, vitamin K oxoreductase). При дефиците витамина K и при снижении активности VKOR нарушается карбоксилирование всех витамин K-зависимых факторов свертывающей и противосвертывающей системы, что резко нарушает их функционирование, поскольку Gla-домен отвечает за взаимодействие факторов свертывания крови с фосфолипидами мембран.
Каталитический домен отвечает за ферментную активность фактора VII, а 2 домена, сходных с эпидермальным фактором роста отвечают за связь фактора VII с ионами кальция. В таком виде неактивный фактор VII поступает в кровь из печени. Активация фактора VII (превращение профермента (=зимогена) в активный фермент, обозначаемый аббревиатурой VIIa происходит в результате разрезания пептидной связи между остатком аргинина (Arg, R) в позиции 323 и остатком изолейцина (Ile, I) в позиции 324.
Фактор VII. Активация.
Итак, разрезание пептидной связи между остатком аргинина 152 и остатком изолейцина 153 приводит к образованию активной формы фактора VII (VIIa). В результате из N-конца пептидной цепочки образуется легкая цепь (мол. масса около 20000, а из C-конца — тяжелая цепь (мол. масса около 30000). Обе цепи остаются ковалентно связанными дисульфидным мосткиком. из N-
Быстрая активация происходит после соединения неактивного фактора VII со своим кофактором (тканевым фактором) в присутствии ионов кальция.
Полиморфизм Arg353Gln
К настоящему времени описано несколько полиморфизмов фактора VII. Большинство полиморфных вариантов приводят к снижению секреции фактора VII в кровь и к снижению активности фактора VII. Уровень антигена фактора VII в крови, отражающий общую концентрацию фактора обычно обозначается аббревиатурой VII:Ag (от слова antigen), а коагулянтная активность фактора, которая может не совпадать с концентрацией антигена — аббревиатурой VII:C (от слова coagulation, свертывание).
Полиморфизм Arg353Gln заключается в замене аргинина на глутамин в позиции 353. В системе однобуквенных кодов аминокислот, предложенной в начале 1960-х годов биохимиком Джоржтаунского университета Маргарет Оукли Дейхофф аргинин обозначается буквой R, а глутамин — буквой Q. Поэтому в литературе этот полиморфизм обозначается также как R353Q. Это одно и то же. Замена одной аминокислоты на другую в цепочке белка обусловлено точечной заменой в позиции 10976 цепочки гена одного азотистого основания (гуанина, G) на другое азотистое основание (аденин, A). Поэтому тот же самый полиморфизм может обозначаться как G10976A. Наличие варианта Gln в гетерозиготном состоянии (R/Q) приводит к снижению концентрации и активности фактора VII в крови на примерно на 25%, а наличие гомозиготности Q/Q — к снижению концентрации и активности фактора примерно на 50% по сравнению с обычными носителями варианта R/R. Данный полиморфизм был впервые описан Green и сотр. в 1991 г.
Концентрация фактора VII в крови находится под влиянием большого количества генетических факторов и факторов внешней среды. Последние включают в себя количество жиров в диете, возраст, наличие ожирения, наличие сахарного диабета, у женщин — начало менопаузы и назначение гормональной заместительной терапии. Концентрация фактора VII в крови хорошо коррелирует с уровнем триглицеридов. Чем выше уровень триглицеридов в крови, тем выше концентрация фактора VII.
Повышение концентрации фактора VII в крови сопровождается повышением риска таких заболеваний, как инфаркт миокарда и гипертоническая болезнь. В случае инфаркта миокарда вероятность летального исхода значительно повышается при высоких концентрациях фактора VII в крови. Во время беременности риск осложнений, связанных с нарушением функции плаценты бывает тем выше, чем выше концентрация фактора VII. Высокие концентрации фактора VII сопровождаются значительным повышением риска тромботических осложнений у женщин на фоне гормональной контрацепции и гормональной заместительной терапии, особенно в сочетании с курением, ожирением и сахарным диабетом.
Исследования последних лет показали, что наличие вариантов Q/Q и R/Q значительно снижает риск возникновения и тяжелого исхода инфаркта миокарда и гипертонической болезни. Более частый вариант R/R, наоборот, является дополнительным фактором риска сосудистых осложнений.
Многие осложнения беременности, сопровождающиеся риском нарушения плацентарной функции (остановка развития беременности на малых сроках, задержка внутриутробного развития, гипотрофия плода, фето-плацентарная недостаточность, некоторые виды аномалий внутриутробного развития плода) связаны с повышением риска тромбозов спиральных артерий. Ситуация усугубляется физиологическим повышением факторов свертывания крови при беременности, таких как фактор II (фибриноген) и фактор VII. Это объясняет интерес акушеров-гинекологов к полиморфизму фактора VII у беременных женщин и к включению определения данного полиморфизма при обследовании при осложненном течении беременности и после многократных неудачных попыток ЭКО. Л. А. Никитина и сотр. (2007) показали, что наличие варианта Gln снижает риск неблагоприятного исхода беременности. Было также установлено, что наличие генотипа R/R у внутриутробного плода является фактором риска атрезии тонкой кишки. Это связано с повышением риска тромбирования сосудов брыжейки у плода, что является одной из важных причин атрезии тонкой кишки (Johnson и Meyers, 2001). Сочетание варианта R/R c лейденской мутацией еще больше повышают риск атрезии тонкого кишки. Для выяснения риска повторения подобных осложнений беременности может потребоваться обследование мужа на полиморфизм генов гемостаза с целью прогнозирования вариантов генотипа плода.
Практические рекомендации по результатам обследования на полиморфизм фактора VII Arg353Gln (R353Q)
- Исследование на полиморфизм R353Q является важной составляющей частью обследования на полиморфизм генов системы гемостаза. Фактором риска, повышающим вероятность осложнений беременности является более частый вариант R. Полиморфный вариант Q снижает риск развития тромботических осложнений беременности.
- При наличии варианта R дополнительным фактором риска повышения концентрации фактора VII являются высокие уровни триглицеридов, избыток массы тела, прием гормональных контрацептивов и гормональной заместительной терапии. Поэтому важным дополнением к исследованию является определение липидограммы у пациента с включением в набор показателей триглицеридов. Липидная панель в таких случаях должна состоять из общего холестерина, липопротеидов низкой плотности, липопротеидов высокой плотности и триглицеридов. Важно также определение уровня глюкозы и проведение сахарной кривой. Обязательным является расчет индекса массы тела у пациента.
- В состав рекомендаций обязательно должны включаться рекомендации по диете, направленной на снижение потребления животных жиров и углеводов, включением в рацион олеиновой и пальмитиновой кислот (омега-3 кислот). Желательна умеренная физическая нагрузка под контролем специалиста по лечебной физкультуры в составе комплекса мер по борьбе с избыточной массой тела.
- Следует помнить, что протективный вариант Q может сочетаться с такими факторами риска тромбофилии как лейденская мутация, гомозиготная форма 4G/4G мутации PAI-1 и т. д., которые могут потребовать назначения гипокоагулянтной терапии в составе низкодозированной ацетилсалициловой кислоты и препаратов гепарина. Относительный дефицит фактора VII у таких пациенток может приводить к повышению риска кровотечений на фоне антикоагулянтной.
- Поскольку внутриутробный плод наследует один экземпляр гена от отца, а другой от матери, и часть осложнений беременности связано не только с генотипом матери, но и с генотипом внутриутробного плода (развитие тромбозов у плода), в некоторых случаях бывает необходимо обследование мужа на полиморфизмы генов системы гемостаза с целью расчета рисков повторения ситуации при следующей беременности и разработки адекватной тактики подготовки к беременности.
Витамин K

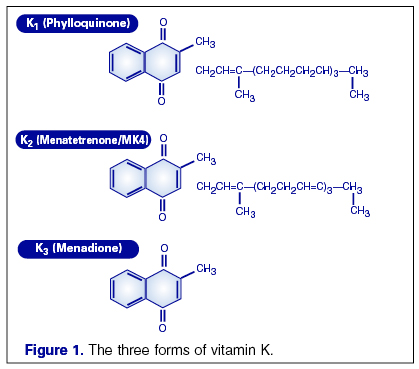
Витамин K включает в себя группу жирорастворимых витаминов, которые необходимы для посттрансляционной модификации нескольких белков, большинство которых является белками свертывающей и противосвертывающей системы крови. Химически они относятся к производным 2-метил-1, 4 нафтохинолона.
Все члены семейства витамина K имеют метилированное нафтохинолоновое кольцо и боковую цепь, содержащую различное число остатков изопрена. Филлохинолон (витамин K1) имеет 4 остатка изопрена в боковой цепи, один из которых ненасыщен. Менахинолоны (витамин K2) содержат различное количество ненасыщенных остатков изопрена. Обычно они обозначаются как MK-n, где n — число остатков изпорена. Наличие остатков изопрена сближает витамины K с другими жирорастворимыми витаминами (A, E и убихинолоны (коэнзимы Q)). Витамины K1 и K2 являются единственными природными витаминами K. Остальные витамины K (K3, K4 и т. д.) являются синтетическими препаратами.
Витамин K1 содержится в зеленых овощах (шпинат, латук, цветная капуста, злаках, авокадо, киви, бананах, в мясе, молочных продуктах, яцах, сое, растительных маслах, в частности, в оливковом масле. Витамин K2 сннтезируется бактериями кишечника, поэтому авитаминоз витамина K у взрослых — редкое являение, в основном — при дисбактериозах после лечения антибиотиками. Однако у маленьких детей, у которых кишечник еще не заселен бактериями в достаточном количестве, нередко наблюдается гиповитаминоз K, который может давать склонность к кровотечениям. Витамин K не проникает через плаценту.
Как указывалось выше, витамин K необходим для карбоксилирования остатков глутаминовой кислоты в некоторых белках, которые превращаются в остатки гамма-карбоксиглутаминовой кислоты (Gla). Белки, которые претерпевают такую посттрансляционную модификацию называются Gla-белками.
У человека известно 14 Gla-белков:
- Белки свертывания крови: протромбин (фактор II), факторы VII, IX, X, протеины C, S и Z
- Белки костного метаболизма: остеокальцин (синоним: костный Gla-протеин, BGP) матриксный Gla-протеин (MGP)
- Участие в восстановлении сосудов (ангиогенезе)
Полиморфизм VKORC1 C1173T
Ген VKORC1 кодирует субъединицу 1 комплекса эпоксид-редуктазы витамина K. Это мембранный протеин, состоящий из одной пептидной цепи, состоящей из 163 аминокислотных остатков, тесно связанный с эндоплазматическим ретикулумом. Как было показано выше, этот фермент переводит неактивную (окисленную) форму витамина K, поступающую в организм, в активную (редуцированную) форму, участвующие в пострансляционном карбоксилировании витамин K-зависимых белков. Дефицит фермента может приводить к тотальному снижению активности всех витамин-K-зависимых факторов.
Как и ожидалось, наибольшая концентрация VKORC1 была обнаружена в клетках печени, в которой синтезируются факторы свертывания крови. Однако активность фермента не ограничивается только клетками печени. Значительная активность была обнаружена и в клетках сосудистой стенки, костной ткани, в плаценте, пуповине и других тканях плода.
Огромный интерес к гену VKORC1 возник после того, как выяснилось, что полиморфизм гена, проявляющийся в виде замены остатка цитозина (C) на остаток тимина (T) в позиции 1173 (первый интрон гена) объясняет различия действия непрямых антикоагулянтов на организм. Было давно замечено, что существует 3 группы людей, с существенными различиями в эффективной дозе непрямых антикоагулянтов. В группу A входят пациенты, требующие минимальной дозы препаратов для достижения клинического эффекта, в группу B — пациенты, которым требуется значительно большая доза и группа AB, которым требуется промежуточная доза. Долгое время было непонятно, с чем связаны такие различия. Возможным объяснением было то, что у разных людей разрушение непрямых антикоагулянтов в организме происходит с разной скоростью. И действительно, был обнаружен полиморфизм в гене фермента, участвующего в разрушении непрямых антикоагулянтов (CYP2C9), частично объясняющим такие различия, однако полностью явление разной чувствительности к непрямым антикоагулянтам оставалось неясным. И только открытие полиморфизма VKORC1 C1173T все расставило по местам. Оказалось, что у людей, являющихся носителями генотипа T/T скорость синтеза, а потому и концентрация фермента внутри клетки минимальная. Поэтому для блокады работы фермента требуются малые дозы препаратов. У людей, имеющих генотип C/C скорость транскрипции гена максимальная, а потому и для блокады фермента требуются большие дозировки. Людям с генотипом C/T требуются промежуточные дозы непрямых антикоагулянтов.
Это открытие поистине произвело революцию в назначении этих препаратов, являющимися одними из важных в лечении и профилактике тромбозов, инфарктов и других сосудистых осложнений. У врачей появился метод прогнозирования оптимальной дозы препарата еще до его назначения. Это позволяет значительно улучшить прогноз лечения: выбрать дозу, адекватно понижающую избыточную свертываемость крови и не создать риска кровотечения. Американское агентство FDA включило исследование полиморфизма VKORC1 в число рекомендуемых перед назначением лечения непрямыми антикоагулянтами.
Дальнейшие исследования позволили предположить роль полиморфизма VKORC1 не только в чувствительности организма к непрямым антикоагулянтам, но и плане возможной предрасположенности к развитию других заболеваний, в частности к венозным тромбозам. По предварительным данным (Circulation 2006; 113: 1615-1621) наличие гаплотипа СС может удваивать риск инфаркта миокарда или инсульта. По данным недавнего французского исследования (Lacut и сотр., октябрь 2007)
Может оказаться, что значение полиморфизма VKORC1 выходит за рамки только подбора дозы оральных антикоагулянтов, поскольку фермент участвует не только в регуляции гемостаза, но и в апоптозе (программируемой смерти клетки), развитии костей, кальцинировании стенки артерий, проведении сигнала и контроле роста. Внимание акушеров должен обратить тот факт, что по предварительным данным вариант C/C в значительно большей степени предрасполагает к образованию кальцинатов в стенке артерий (Teichert M. и сотр., январь 2008). Скорее всего, в ближайшее время будут проведены исследования о возможной связи старения плаценты и образования в ней кальцинатов с полиморфизмом гена VKORС1.
Отдельная тема, почти не исследованная на сегодняшний день — это значение полиморфизма VKORC1 для риска осложнений беременности. Было показано, что высокая активность фермента внутри клеток коррелирует с пролиферацией, миграцией, адгезией и формированием сосудистой сети клеток эндотелия пуповины (Wang и сотр., 2006). Можно предположить, что наличие вариантных генотипов VKORC1 у плода может влиять на плацентацию и ангиогенез в плаценте. Вариант C/C является неблагоприятным вариантом в случае дефицита витамина K в организме. Дефицит витамина K у беременных обнаруживается довольно редко, однако не исключен. Вероятность его повышается в случае неправильной диеты, после лечения антибиотиками, при хронических заболеваниях печени. В марте 2005 г. французские авторы (Jessica Jaillet и сотр.) опубликовали случай рождения ребенка с синдромом Биндера (неправильное формирование носа и верхней челюсти) у женщины с желчекаменной болезнью и доказанным дефицитом витамина K в первом триместре. В 11 недель беременности у женщины было обнаружено снижение факторов II, VII, X свертывания крови, а также удлинение протромбинового времени, характерных признаков дефицита витамина K. Хотя это единственный опубликованный на сегодняшний день случай, он не должен пройти без внимания врачей акушеров-гинекологов. При наличии дисбактериоза или других факторов риска дефицита витамина K женщинам с генотипом C/C можно было предложить несколько инъекций витамина K на этапе подготовки к беременности.
Заключение
Мы затронули одну из важных тем современной медицины: значение генов витамин-K-зависимых факторов для здоровья и болезни. Возможности современной лабораторной диагностики позволяют выяснить конфигурацию генов у человека и на основе этой конфигурации разработать меры по профилактике заболеваний и продлению жизни человека, обеспечению здоровья потомства. Данная статья является продолжением наших публикаций по геномике и молекулярной генетике: